よむ、つかう、まなぶ。
参考資料4:総薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会報告書 (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43236.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第36回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(2)検討会における議論
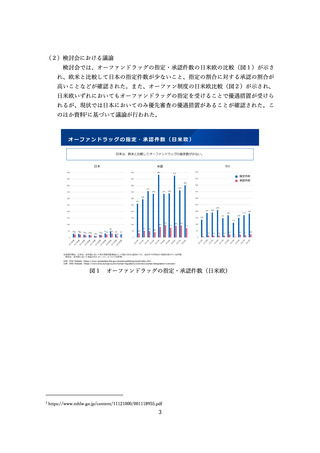
臨床試験の倫理審査に係る日米欧の状況(図7)や、治験費用のポイント制に関す
る現状、治験実施の煩雑さに係る現状等について、事務局作成の資料16に基づいて議
論が進められた。
臨床試験の倫理審査に係る日米欧の状況
⚫ EUでは法令に基づいて中央IRBのみにより運用。
⚫ 米国は、過去には施設IRBを基本としてきたが、実際の運用では、中央IRBが普及している。
日本
米国
EU
施設IRB又は中央IRB
施設IRB又は中央IRB
中央IRB等
• 特になし(平成20年のGCP省令
改正により医療機関毎のIRB設置
原則が廃止)
• 中央IRBの利用を促進するため、
2006年にFDAガイダンスが策定
された(法的拘束力はなく、推
奨事項をとりまとめたもの)。
• NIHが資金提供する臨床試験につ
いては単一IRBによる審査を求め
るNIHガイダンスが2016年に公
表された。
• EU指令による規定(Directive
2001/20/EC)において加盟国毎
に1つの意見となる手続きとす
るよう定められている。
• 2021年NDAに用いられた試験の
48%はCommercial IRB
• その92%を2社(WCG, ADVARRA
社)が占有
• EU加盟国ごとに一つの倫理委員
会の承認と当局の許可があれば、
試験開始可能
• 少数の倫理委員会(例えば、フ
ランスは39委員会、英国は8
7委員会)
• 申請者は倫理委員会を自由に選
ぶことはできない(例えば、フ
ランスは審査を受ける委員会は
くじ 引きで決まる)
3
倫理審査の形式
ガイダンス等
運用実態
• 国立病院機構やクリニックを中
心に利用が進んでいるが、大学
病院等では十分に普及していな
い。
図7 臨床試験の倫理審査に係る日米欧の状況
(3)対応の方向性
①
中央 IRB の活用促進
原則として中央 IRB による審査が望ましい点を文書化する方向性を含め、中央
IRB の活用の促進に向けた検討を進めるべきであり、具体的には、医療関係者の意
見も聴きつつ、厚生労働省・PMDA・製薬業界において検討を進めるべきこととし
た。
②
治験費用の算定方法の合理化
治験費用の算定方法について、業務量や市場価格に基づいた算定(欧米では Fair
Market Value と呼ばれ、広く浸透している概念)の国内への導入の実現性を含め、
医療機関・治験依頼者双方が納得感を得られる方法について必要な検討を進めるべ
きこととした。
③
治験運用の更なる合理化
例えば以下のような点について、医療機関を含む関係者の意見も聴きつつ、厚生
16
https://www.mhlw.go.jp/content/11121000/001230278.pdf
25
臨床試験の倫理審査に係る日米欧の状況(図7)や、治験費用のポイント制に関す
る現状、治験実施の煩雑さに係る現状等について、事務局作成の資料16に基づいて議
論が進められた。
臨床試験の倫理審査に係る日米欧の状況
⚫ EUでは法令に基づいて中央IRBのみにより運用。
⚫ 米国は、過去には施設IRBを基本としてきたが、実際の運用では、中央IRBが普及している。
日本
米国
EU
施設IRB又は中央IRB
施設IRB又は中央IRB
中央IRB等
• 特になし(平成20年のGCP省令
改正により医療機関毎のIRB設置
原則が廃止)
• 中央IRBの利用を促進するため、
2006年にFDAガイダンスが策定
された(法的拘束力はなく、推
奨事項をとりまとめたもの)。
• NIHが資金提供する臨床試験につ
いては単一IRBによる審査を求め
るNIHガイダンスが2016年に公
表された。
• EU指令による規定(Directive
2001/20/EC)において加盟国毎
に1つの意見となる手続きとす
るよう定められている。
• 2021年NDAに用いられた試験の
48%はCommercial IRB
• その92%を2社(WCG, ADVARRA
社)が占有
• EU加盟国ごとに一つの倫理委員
会の承認と当局の許可があれば、
試験開始可能
• 少数の倫理委員会(例えば、フ
ランスは39委員会、英国は8
7委員会)
• 申請者は倫理委員会を自由に選
ぶことはできない(例えば、フ
ランスは審査を受ける委員会は
くじ 引きで決まる)
3
倫理審査の形式
ガイダンス等
運用実態
• 国立病院機構やクリニックを中
心に利用が進んでいるが、大学
病院等では十分に普及していな
い。
図7 臨床試験の倫理審査に係る日米欧の状況
(3)対応の方向性
①
中央 IRB の活用促進
原則として中央 IRB による審査が望ましい点を文書化する方向性を含め、中央
IRB の活用の促進に向けた検討を進めるべきであり、具体的には、医療関係者の意
見も聴きつつ、厚生労働省・PMDA・製薬業界において検討を進めるべきこととし
た。
②
治験費用の算定方法の合理化
治験費用の算定方法について、業務量や市場価格に基づいた算定(欧米では Fair
Market Value と呼ばれ、広く浸透している概念)の国内への導入の実現性を含め、
医療機関・治験依頼者双方が納得感を得られる方法について必要な検討を進めるべ
きこととした。
③
治験運用の更なる合理化
例えば以下のような点について、医療機関を含む関係者の意見も聴きつつ、厚生
16
https://www.mhlw.go.jp/content/11121000/001230278.pdf
25