よむ、つかう、まなぶ。
参考資料4:総薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会報告書 (35 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43236.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第36回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
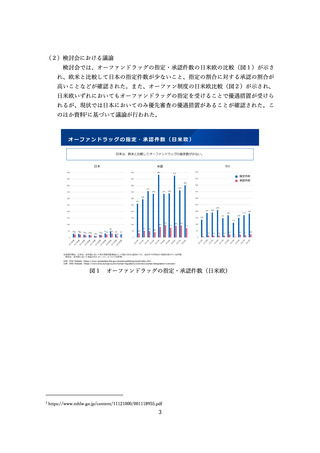
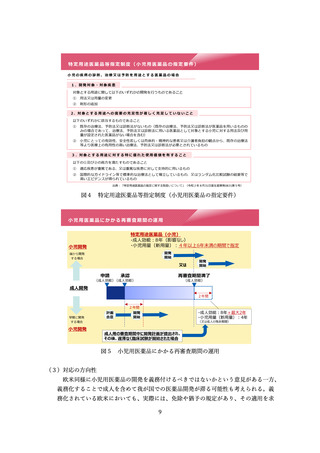
ア医薬品・医療機器規制調和グランドデザイン』実行戦略」(令和2年7月 14 日健
康・医療戦略推進本部決定)等に基づき、アジア諸国との間で、薬事規制の調和、及
びリライアンス(日本の審査結果を参照した相手国での簡略審査)の推進が求められ
ている。これまで、PMDA アジア医薬品・医療機器トレーニングセンターにおいて、
アジア規制当局担当者に対する薬事規制制度に関するセミナー・研修を積極的に実施
してきた(2016~2022 年度に合計 85 回のセミナーを開催、67 の国/地域及び WHO
からのべ 2,570 人(うちアジア諸国から 2,210 人)の規制当局担当者が参加)。これら
により日本の薬事規制に対する理解・信頼が向上し、日本の審査結果を参照する制度
(簡略審査制度)を導入するアジア諸国が年毎に拡大しており、引き続き当該活動を
継続することを予定している。
(3)検討会での意見
検討会では、次のような意見があった。こうした意見を踏まえつつ、今後の事業を
実施していくべきこととされた。
○
アメリカの事務所に赴任される方々のマインドセットの切り替えをしてほしい。
これまでは PMDA は自らのことを売り込みに行くということはなかったと思うが、
エマージングバイオファーマに日本の方を向いてもらうためには、受け身ではなく、
プロアクティブに日本を売り込んでいただきたい。また、そういった方々に会って
話をきいてほしい。
○
ベンチャー企業の資金の出し手であるベンチャー・キャピタルや、実際に導入を
代わりに担う製薬企業への働きかけも行ってほしい。
○
国内外での規制の違いについて、分析をするべき。現状のスキームでは何がうま
くいって、何が駄目なのかについての分析が必要。
○
海外向けの情報発信にあたっては、誤解を解消するような説明も必要。業界側か
らの制度の見方に偏った情報が広まっており、誤解が生じている場合がある。
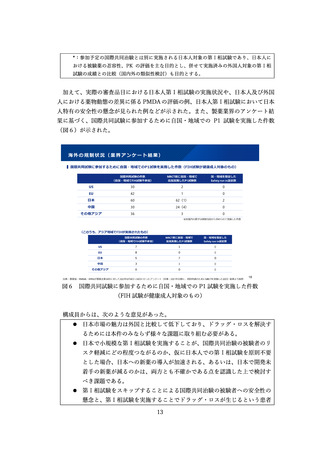
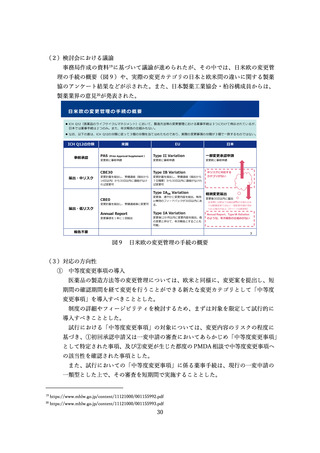
11.新規モダリティにおけるドラッグラグ・ロスの現状
事務局から、「医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会」
に記載されている事項以外にも、「創薬力の強化」の点で薬事制度について検討が必要
な論点があると考えられることから、ボストン コンサルティング グループ ジャパン・
柳本構成員にプレゼンテーションを依頼した。柳本構成員からは、資料 24に従って説明
がされた。
構成員からは、次のような意見があった。
○
新規モダリティの評価手法については、グローバル企業では日本と欧米でコミュニ
ケーションをとりながら検討している。PMDA にも民間企業と連携して評価手法の検
24
https://www.mhlw.go.jp/content/11121000/001207145.pdf
35
康・医療戦略推進本部決定)等に基づき、アジア諸国との間で、薬事規制の調和、及
びリライアンス(日本の審査結果を参照した相手国での簡略審査)の推進が求められ
ている。これまで、PMDA アジア医薬品・医療機器トレーニングセンターにおいて、
アジア規制当局担当者に対する薬事規制制度に関するセミナー・研修を積極的に実施
してきた(2016~2022 年度に合計 85 回のセミナーを開催、67 の国/地域及び WHO
からのべ 2,570 人(うちアジア諸国から 2,210 人)の規制当局担当者が参加)。これら
により日本の薬事規制に対する理解・信頼が向上し、日本の審査結果を参照する制度
(簡略審査制度)を導入するアジア諸国が年毎に拡大しており、引き続き当該活動を
継続することを予定している。
(3)検討会での意見
検討会では、次のような意見があった。こうした意見を踏まえつつ、今後の事業を
実施していくべきこととされた。
○
アメリカの事務所に赴任される方々のマインドセットの切り替えをしてほしい。
これまでは PMDA は自らのことを売り込みに行くということはなかったと思うが、
エマージングバイオファーマに日本の方を向いてもらうためには、受け身ではなく、
プロアクティブに日本を売り込んでいただきたい。また、そういった方々に会って
話をきいてほしい。
○
ベンチャー企業の資金の出し手であるベンチャー・キャピタルや、実際に導入を
代わりに担う製薬企業への働きかけも行ってほしい。
○
国内外での規制の違いについて、分析をするべき。現状のスキームでは何がうま
くいって、何が駄目なのかについての分析が必要。
○
海外向けの情報発信にあたっては、誤解を解消するような説明も必要。業界側か
らの制度の見方に偏った情報が広まっており、誤解が生じている場合がある。
11.新規モダリティにおけるドラッグラグ・ロスの現状
事務局から、「医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会」
に記載されている事項以外にも、「創薬力の強化」の点で薬事制度について検討が必要
な論点があると考えられることから、ボストン コンサルティング グループ ジャパン・
柳本構成員にプレゼンテーションを依頼した。柳本構成員からは、資料 24に従って説明
がされた。
構成員からは、次のような意見があった。
○
新規モダリティの評価手法については、グローバル企業では日本と欧米でコミュニ
ケーションをとりながら検討している。PMDA にも民間企業と連携して評価手法の検
24
https://www.mhlw.go.jp/content/11121000/001207145.pdf
35