よむ、つかう、まなぶ。
参考資料4:総薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会報告書 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43236.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第36回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(2)検討会における議論
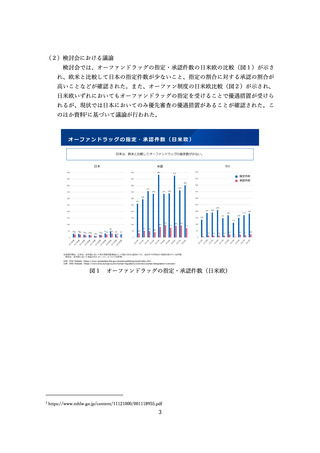
検討会では、オーファンドラッグの指定・承認件数の日米欧の比較(図1)が示さ
れ、欧米と比較して日本の指定件数が少ないこと、指定の割合に対する承認の割合が
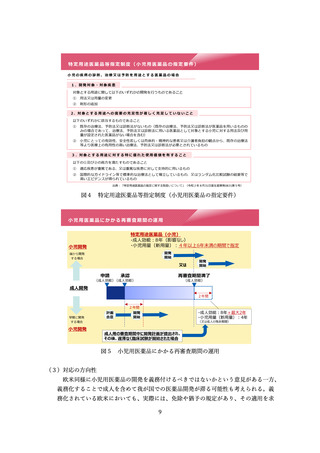
高いことなどが確認された。また、オーファン制度の日米欧比較(図2)が示され、
日米欧いずれにおいてもオーファンドラッグの指定を受けることで優遇措置が受けら
れるが、現状では日本においてのみ優先審査の優遇措置があることが確認された。こ
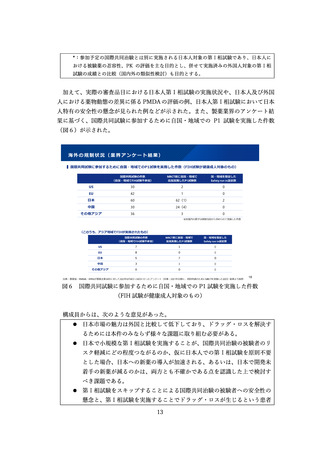
のほか資料2に基づいて議論が行われた。
オーファンドラッグの指定・承認件数(日米欧)
日本は、欧米と比較してオーファンドラッグの指定数が少ない。
日本
EU
米国
500
500
450
450
483
500
476
400
400
337
336
350
承認件数
400
363
357
350
指定件数
450
402
340
350
294
300
300
300
250
250
250
200
200
200
150
150
150
100
100
261
209
187
190
170
169
182
149
147
136
112
50
0
2923
2824
2218
2018
1210
2118
31
24
48
31
82
52
26
10
50
25
34
49
95
75
90
93
41
73
100
50
7
2
15
14
14
14
22
0
0
※承認件数は、日本は、各年度において希少疾病用医薬品として指定された品目のうち、2023年4月時点で承認を受けている件数。
欧米は、各年度において承認されたオーファンドラッグの件数
出典:FDA Website(https://www.accessdata.fda.gov/scripts/opdlisting/oopd/index.cfm)
出典:EMA Website(https://www.ema.europa.eu/en/human-regulatory/overview/orphan-designation-overview)
図1 オーファンドラッグの指定・承認件数(日米欧)
2
https://www.mhlw.go.jp/content/11121000/001118955.pdf
3
5
21
17
24
検討会では、オーファンドラッグの指定・承認件数の日米欧の比較(図1)が示さ
れ、欧米と比較して日本の指定件数が少ないこと、指定の割合に対する承認の割合が
高いことなどが確認された。また、オーファン制度の日米欧比較(図2)が示され、
日米欧いずれにおいてもオーファンドラッグの指定を受けることで優遇措置が受けら
れるが、現状では日本においてのみ優先審査の優遇措置があることが確認された。こ
のほか資料2に基づいて議論が行われた。
オーファンドラッグの指定・承認件数(日米欧)
日本は、欧米と比較してオーファンドラッグの指定数が少ない。
日本
EU
米国
500
500
450
450
483
500
476
400
400
337
336
350
承認件数
400
363
357
350
指定件数
450
402
340
350
294
300
300
300
250
250
250
200
200
200
150
150
150
100
100
261
209
187
190
170
169
182
149
147
136
112
50
0
2923
2824
2218
2018
1210
2118
31
24
48
31
82
52
26
10
50
25
34
49
95
75
90
93
41
73
100
50
7
2
15
14
14
14
22
0
0
※承認件数は、日本は、各年度において希少疾病用医薬品として指定された品目のうち、2023年4月時点で承認を受けている件数。
欧米は、各年度において承認されたオーファンドラッグの件数
出典:FDA Website(https://www.accessdata.fda.gov/scripts/opdlisting/oopd/index.cfm)
出典:EMA Website(https://www.ema.europa.eu/en/human-regulatory/overview/orphan-designation-overview)
図1 オーファンドラッグの指定・承認件数(日米欧)
2
https://www.mhlw.go.jp/content/11121000/001118955.pdf
3
5
21
17
24