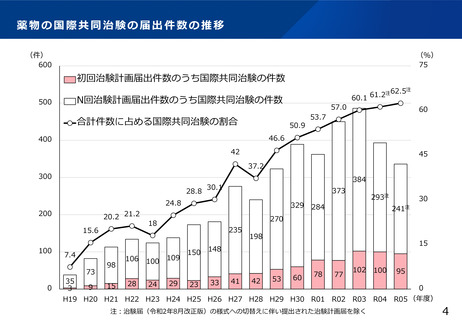
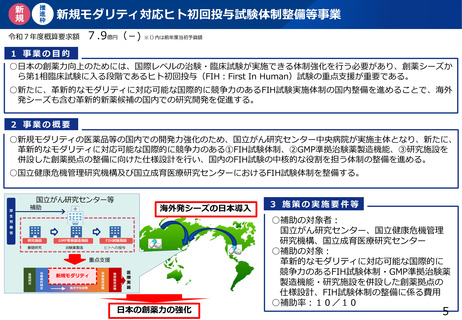
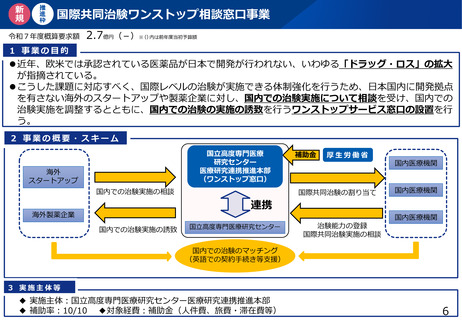
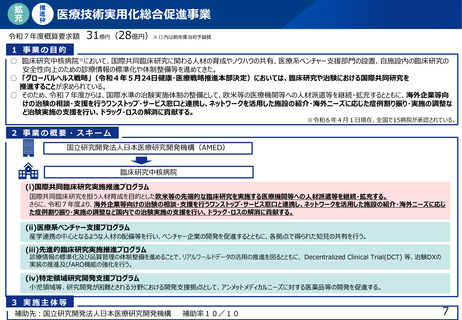
よむ、つかう、まなぶ。
資料2:臨床研究・治験推進に係る今後の方向性について (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44426.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第37回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
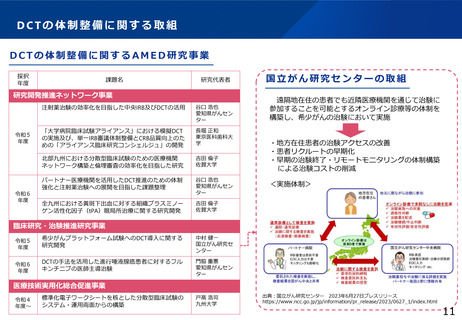
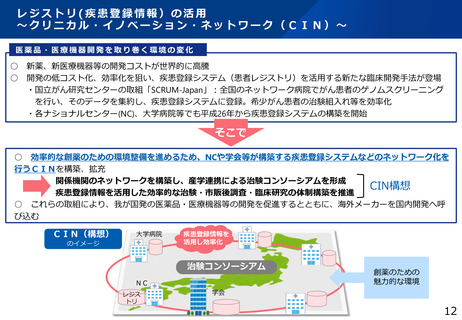
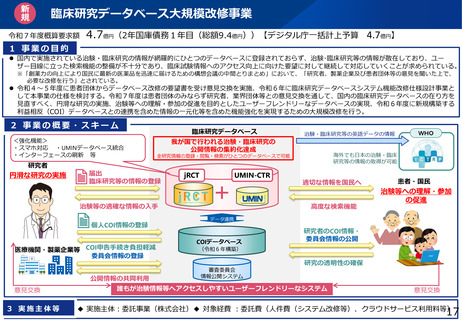
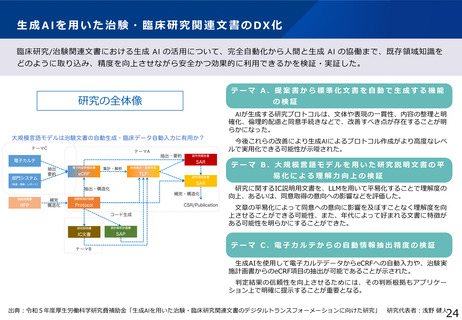
臨床研究データベース大規模改修事業
令和7年度概算要求額
4.7億円(2年国庫債務1年目(総額9.4億円))【デジタル庁一括計上予算 4.7億円】
1 事業の目的
⚫ 国内で実施されている治験・臨床研究の情報が網羅的にひとつのデータベースに登録されておらず、治験・臨床研究等の情報が散在しており、ユー
ザー目線に立った検索機能の整備が不十分であり、臨床試験情報へのアクセス向上に向けた要望に対して継続して対応していくことが求められている。
※「創薬力の向上により国民に最新の医薬品を迅速に届けるための構想会議の中間とりまとめ」において、「研究者、製薬企業及び患者団体等の意見を聞いた上で、
必要な改修を行う」とされている。
⚫ 令和4~5年度に患者団体からデータベース改修の要望書を受け意見交換を実施、令和6年に臨床研究データベースシステム機能改修仕様設計事業と
して本事業の仕様を検討する。令和7年度は患者団体のみならず研究者、業界団体等との意見交換を通して、国内の臨床研究データベースの在り方を
見直すべく、円滑な研究の実施、治験等への理解・参加の促進を目的としたユーザーフレンドリーなデータベースの実現、令和6年度に新規構築する
利益相反(COI)データベースとの連携を含めた情報の一元化等を含めた機能強化を実現するための大規模改修を行う。
2 事業の概要・スキーム
<強化機能>
・スマホ対応 ・UMINデータベース統合
・インターフェースの刷新 等
臨床研究データベース
治験・臨床研究等の英語データの情報
我が国で行われる治験・臨床研究の
公開情報の集約化達成
海外でも日本の治験・臨床
研究等の情報の取得が可能
全研究情報の登録・閲覧・検索がひとつのデータベースで可能
研究者
円滑な研究の実施
届出
臨床研究等の情報の登録
jRCT
UMIN-CTR
+
治験等の適確な情報の入手
個人COI情報の登録
医療機関・製薬企業等 COI申告手続き負担軽減
委員会情報の登録
公開情報の共同利用
意見交換
3 実施主体等
WHO
適切な情報を国民へ
高度な検索機能
患者・国民
治験等への理解・参加
の促進
データ連携
COIデータベース
研究者のCOI情報・
委員会情報の公開
(令和6年構築)
研究の透明性の確保
審査委員会
情報公開システム
誰もが治験情報等へアクセスしやすいユーザーフレンドリーなシステム
意見交換
◆ 実施主体:委託事業(株式会社)◆ 対象経費 :委託費(人件費(システム改修等)、クラウドサービス利用料等)
17
令和7年度概算要求額
4.7億円(2年国庫債務1年目(総額9.4億円))【デジタル庁一括計上予算 4.7億円】
1 事業の目的
⚫ 国内で実施されている治験・臨床研究の情報が網羅的にひとつのデータベースに登録されておらず、治験・臨床研究等の情報が散在しており、ユー
ザー目線に立った検索機能の整備が不十分であり、臨床試験情報へのアクセス向上に向けた要望に対して継続して対応していくことが求められている。
※「創薬力の向上により国民に最新の医薬品を迅速に届けるための構想会議の中間とりまとめ」において、「研究者、製薬企業及び患者団体等の意見を聞いた上で、
必要な改修を行う」とされている。
⚫ 令和4~5年度に患者団体からデータベース改修の要望書を受け意見交換を実施、令和6年に臨床研究データベースシステム機能改修仕様設計事業と
して本事業の仕様を検討する。令和7年度は患者団体のみならず研究者、業界団体等との意見交換を通して、国内の臨床研究データベースの在り方を
見直すべく、円滑な研究の実施、治験等への理解・参加の促進を目的としたユーザーフレンドリーなデータベースの実現、令和6年度に新規構築する
利益相反(COI)データベースとの連携を含めた情報の一元化等を含めた機能強化を実現するための大規模改修を行う。
2 事業の概要・スキーム
<強化機能>
・スマホ対応 ・UMINデータベース統合
・インターフェースの刷新 等
臨床研究データベース
治験・臨床研究等の英語データの情報
我が国で行われる治験・臨床研究の
公開情報の集約化達成
海外でも日本の治験・臨床
研究等の情報の取得が可能
全研究情報の登録・閲覧・検索がひとつのデータベースで可能
研究者
円滑な研究の実施
届出
臨床研究等の情報の登録
jRCT
UMIN-CTR
+
治験等の適確な情報の入手
個人COI情報の登録
医療機関・製薬企業等 COI申告手続き負担軽減
委員会情報の登録
公開情報の共同利用
意見交換
3 実施主体等
WHO
適切な情報を国民へ
高度な検索機能
患者・国民
治験等への理解・参加
の促進
データ連携
COIデータベース
研究者のCOI情報・
委員会情報の公開
(令和6年構築)
研究の透明性の確保
審査委員会
情報公開システム
誰もが治験情報等へアクセスしやすいユーザーフレンドリーなシステム
意見交換
◆ 実施主体:委託事業(株式会社)◆ 対象経費 :委託費(人件費(システム改修等)、クラウドサービス利用料等)
17