よむ、つかう、まなぶ。
資料2:臨床研究・治験推進に係る今後の方向性について (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44426.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第37回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
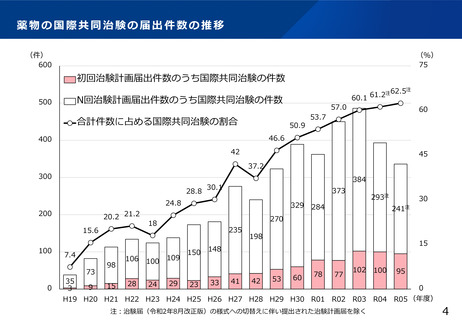
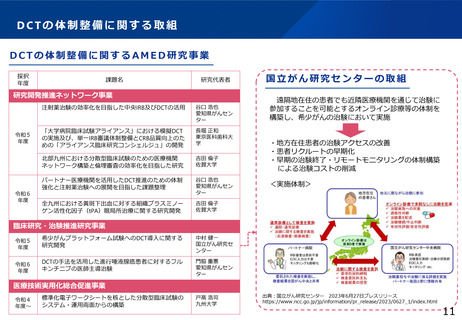
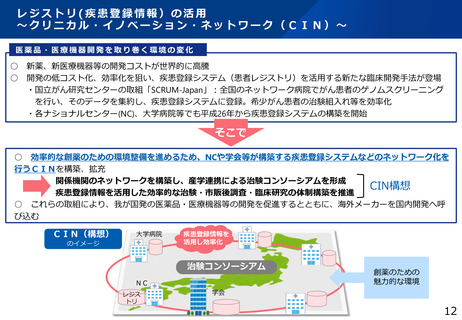
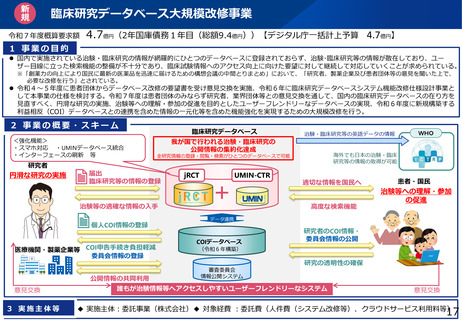
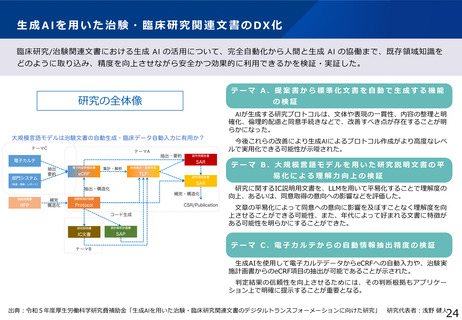
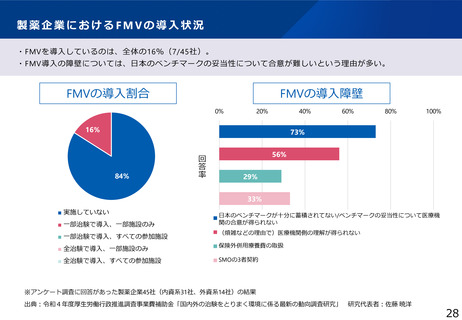
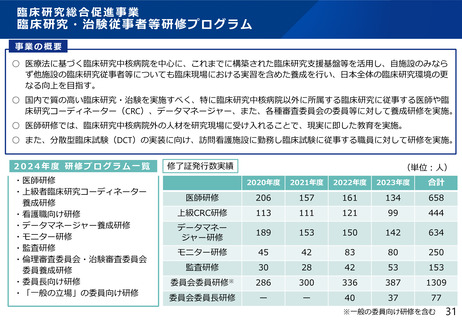
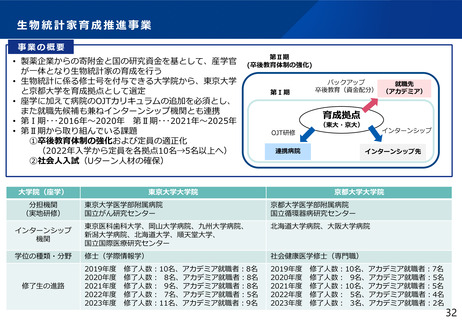
治験文書・手続きの電子化状況
・日本製薬工業協会が実施したアンケート調査では、電子化を実施するためのSOP整備状況は70%の企業において整
備済みである一方、依頼者から医療機関への資料授受では90%以上の企業で紙での運用が残っていた。
・一方、医療機関における電子化の対応可能割合は19%~55%であり、治験依頼者側と医療機関側との整備状況には
ギャップが認められた。
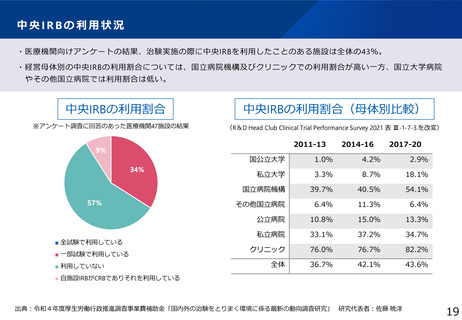
医療機関の電子化の状況
製薬企業の電子化の状況
※アンケート調査に回答のあった医療機関47施設の結果
(日本製薬工業協会 医薬品評価委員会 臨床評価部会
「治験の現状に関するアンケート調査結果について」(2021年度))
0%
20%
40%
60%
80%
100%
全ての文書で可能
13%
70.5
電磁化SOP整備状況
n=44
29.5
SOP整備済み
IRBへの新規資料提出
申請前ヒアリング
17%
38%
一部文書のみ可能
34%
49%
一部文書のみ可能
全て不可
SOP整備前
32%
申請前ヒアリングは実
全ての文書で可能
全て不可
17%
施していない
0%
依頼者から医療機関へ
提供する資料
n=44
依頼者が医療機関から
受領する資料
n=43
6.8
4.7
20%
40%
54.5
55.8
全てを電子原本とする
60%
80%
100%
IRBでの継続・有害事象審査
治験契約
38.6
19%
39.5
一部を電子原本とする
9%
未対応
72%
全ての文書で可能
32%
全ての文書で可能
一部文書のみ可能
55%
全て不可
一部文書のみ可能
全て不可
13%
出典:令和4年度厚生労働行政推進調査事業費補助金「国内外の治験をとりまく環境に係る最新の動向調査研究」 研究代表者:佐藤 暁洋
20
・日本製薬工業協会が実施したアンケート調査では、電子化を実施するためのSOP整備状況は70%の企業において整
備済みである一方、依頼者から医療機関への資料授受では90%以上の企業で紙での運用が残っていた。
・一方、医療機関における電子化の対応可能割合は19%~55%であり、治験依頼者側と医療機関側との整備状況には
ギャップが認められた。
医療機関の電子化の状況
製薬企業の電子化の状況
※アンケート調査に回答のあった医療機関47施設の結果
(日本製薬工業協会 医薬品評価委員会 臨床評価部会
「治験の現状に関するアンケート調査結果について」(2021年度))
0%
20%
40%
60%
80%
100%
全ての文書で可能
13%
70.5
電磁化SOP整備状況
n=44
29.5
SOP整備済み
IRBへの新規資料提出
申請前ヒアリング
17%
38%
一部文書のみ可能
34%
49%
一部文書のみ可能
全て不可
SOP整備前
32%
申請前ヒアリングは実
全ての文書で可能
全て不可
17%
施していない
0%
依頼者から医療機関へ
提供する資料
n=44
依頼者が医療機関から
受領する資料
n=43
6.8
4.7
20%
40%
54.5
55.8
全てを電子原本とする
60%
80%
100%
IRBでの継続・有害事象審査
治験契約
38.6
19%
39.5
一部を電子原本とする
9%
未対応
72%
全ての文書で可能
32%
全ての文書で可能
一部文書のみ可能
55%
全て不可
一部文書のみ可能
全て不可
13%
出典:令和4年度厚生労働行政推進調査事業費補助金「国内外の治験をとりまく環境に係る最新の動向調査研究」 研究代表者:佐藤 暁洋
20