よむ、つかう、まなぶ。
総-6参考2[1.1MB] (17 ページ)
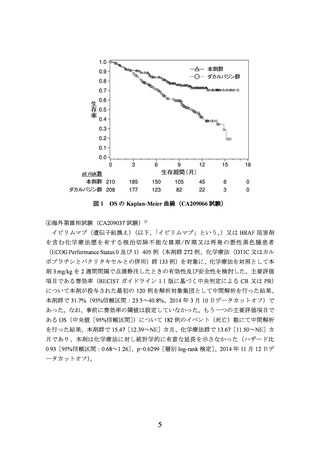
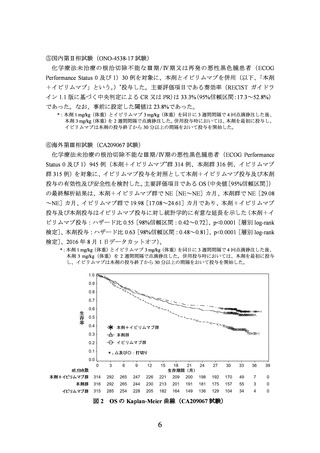
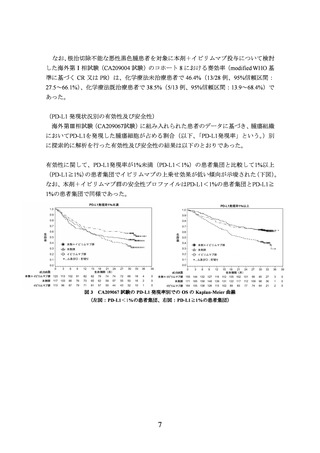
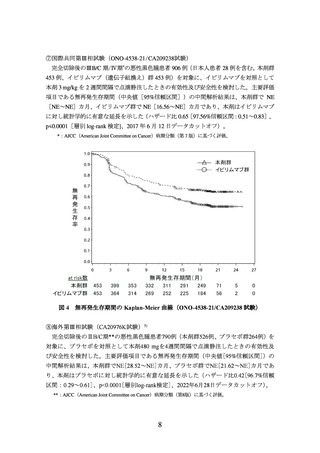
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_53715.html |
| 出典情報 | 中央社会保険医療協議会 総会(第605回 3/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
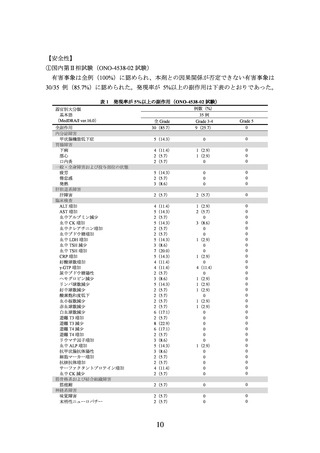
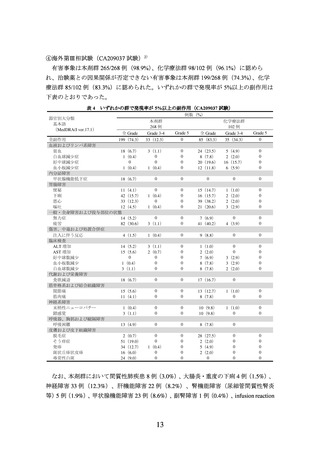
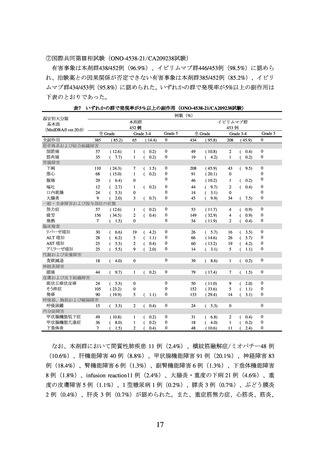
器官別大分類
基本語
(MedDRA/J ver.19.0)
本剤+イピリムマブ群
313 例
全 Grade
Grade 3-4 Grade 5
0
43(13.7) 34(10.9)
0
0
19(6.1)
リパーゼ増加
体重減少
代謝および栄養障害
食欲減退
60(19.2)
筋骨格系および結合組織障害
関節痛
42(13.4)
筋肉痛
17(5.4)
神経系障害
浮動性めまい
17(5.4)
味覚異常
14(4.5)
頭痛
34(10.9)
呼吸器、胸郭および縦隔障害
咳嗽
24(7.7)
呼吸困難
36(11.5)
肺臓炎
21(6.7)
皮膚および皮下組織障害
皮膚乾燥
15(4.8)
そう痒症
112(35.8)
発疹
91(29.1)
斑状丘疹状皮疹
38(12.1)
尋常性白斑
27(8.6)
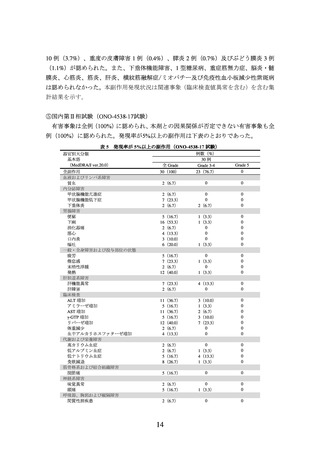
例数(%)
本剤群
313 例
全 Grade
Grade 3-4
24(7.7) 12(3.8)
0
10(3.2)
Grade 5
0
0
イピリムマブ群
311 例
全 Grade
Grade 3-4 Grade 5
0
18(5.8)
12(3.9)
0
4(1.3)
1(0.3)
4(1.3)
0
36(11.5)
0
0
41(13.2)
1(0.3)
0
1(0.3)
1(0.3)
0
0
29(9.3)
15(4.8)
1(0.3)
1(0.3)
0
0
21(6.8)
9(2.9)
0
0
0
0
0
0
2(0.6)
0
0
0
15(4.8)
18(5.8)
24(7.7)
0
0
0
0
0
0
11(3.5)
9(2.9)
25(8.0)
0
0
1(0.3)
0
0
0
0
3(1.0)
3(1.0)
0
0
0
20(6.4)
20(6.4)
4(1.3)
2(0.6)
1(0.3)
1(0.3)
0
0
0
15(4.8)
12(3.9)
5(1.6)
0
0
1(0.3)
0
0
0
0
6(1.9)
10(3.2)
6(1.9)
0
0
0
0
0
0
17(5.4)
67(21.4)
72(23.0)
14(4.5)
28(8.9)
0
1(0.3)
1(0.3)
2(0.6)
1(0.3)
0
0
0
0
0
11(3.5)
113(36.3)
68(21.9)
38(12.2)
16(5.1)
0
1(0.3)
5(1.6)
1(0.3)
0
0
0
0
0
0
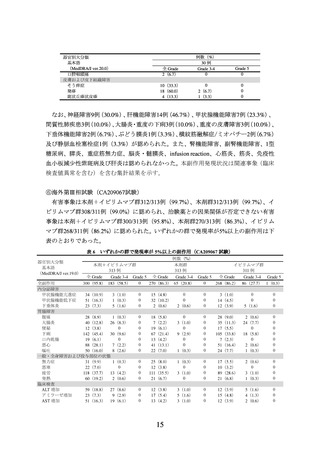
なお、本剤+イピリムマブ群において神経障害86例(27.5%)、肝機能障害102例
(32.6%)、甲状腺機能障害87例(27.8%)、腎機能障害21例(6.7%)、間質性肺疾患25
例(8.0%)、大腸炎・重度の下痢60例(19.2%)、重度の皮膚障害21例(6.7%)、下垂
体機能障害27例(8.6%)、副腎機能障害14例(4.5%)、膵炎3例(1.0%)、脳炎・髄膜
炎2例(0.6%)、infusion reaction 13例(4.2%)、ぶどう膜炎3例(1.0%)、筋炎3例(1.0%)、
横紋筋融解症/ミオパチー50例(16.0%)、肝炎14例(4.5%)及び静脈血栓塞栓症2例(0.6%)
が認められた。また、1型糖尿病、重症筋無力症、心筋炎及び免疫性血小板減少性紫斑
病は認められなかった。本剤群において神経障害66例(21.1%)、肝機能障害24例(7.7%)、
甲状腺機能障害47例(15.0%)、腎機能障害3例(1.0%)、間質性肺疾患5例(1.6%)、
大腸炎・重度の下痢16例(5.1%)、重度の皮膚障害8例(2.6%)、下垂体機能障害3例(1.0%)、
副腎機能障害3例(1.0%)、膵炎3例(1.0%)、infusion reaction 14例(4.5%)、ぶどう膜
炎2例(0.6%)、横紋筋融解症/ミオパチー28例(8.9%)、肝炎2例(0.6%)及び静脈血
栓塞栓症1例(0.3%)が認められた。また、1型糖尿病、重症筋無力症、脳炎・髄膜炎、
心筋炎、筋炎及び免疫性血小板減少性紫斑病は認められなかった。本副作用発現状況は
関連事象(臨床検査値異常を含む)を含む集計結果を示す。
根治切除不能な悪性黒色腫患者を対象に本剤+イピリムマブ投与を検討した海外第
Ⅰ相試験(CA209004 試験)のコホート 8 において、化学療法未治療患者 28 例と化学療
法既治療患者 13 例との間で、安全性に明確な差異は認められなかった。
16
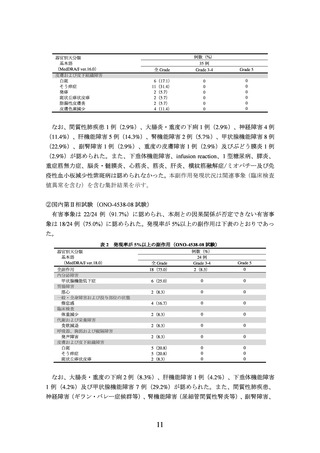
基本語
(MedDRA/J ver.19.0)
本剤+イピリムマブ群
313 例
全 Grade
Grade 3-4 Grade 5
0
43(13.7) 34(10.9)
0
0
19(6.1)
リパーゼ増加
体重減少
代謝および栄養障害
食欲減退
60(19.2)
筋骨格系および結合組織障害
関節痛
42(13.4)
筋肉痛
17(5.4)
神経系障害
浮動性めまい
17(5.4)
味覚異常
14(4.5)
頭痛
34(10.9)
呼吸器、胸郭および縦隔障害
咳嗽
24(7.7)
呼吸困難
36(11.5)
肺臓炎
21(6.7)
皮膚および皮下組織障害
皮膚乾燥
15(4.8)
そう痒症
112(35.8)
発疹
91(29.1)
斑状丘疹状皮疹
38(12.1)
尋常性白斑
27(8.6)
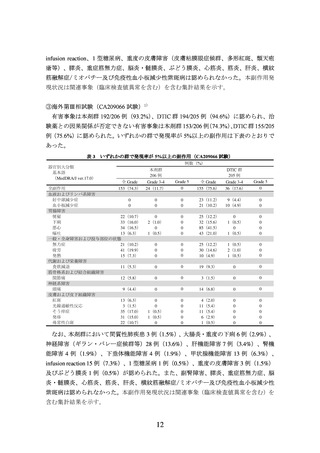
例数(%)
本剤群
313 例
全 Grade
Grade 3-4
24(7.7) 12(3.8)
0
10(3.2)
Grade 5
0
0
イピリムマブ群
311 例
全 Grade
Grade 3-4 Grade 5
0
18(5.8)
12(3.9)
0
4(1.3)
1(0.3)
4(1.3)
0
36(11.5)
0
0
41(13.2)
1(0.3)
0
1(0.3)
1(0.3)
0
0
29(9.3)
15(4.8)
1(0.3)
1(0.3)
0
0
21(6.8)
9(2.9)
0
0
0
0
0
0
2(0.6)
0
0
0
15(4.8)
18(5.8)
24(7.7)
0
0
0
0
0
0
11(3.5)
9(2.9)
25(8.0)
0
0
1(0.3)
0
0
0
0
3(1.0)
3(1.0)
0
0
0
20(6.4)
20(6.4)
4(1.3)
2(0.6)
1(0.3)
1(0.3)
0
0
0
15(4.8)
12(3.9)
5(1.6)
0
0
1(0.3)
0
0
0
0
6(1.9)
10(3.2)
6(1.9)
0
0
0
0
0
0
17(5.4)
67(21.4)
72(23.0)
14(4.5)
28(8.9)
0
1(0.3)
1(0.3)
2(0.6)
1(0.3)
0
0
0
0
0
11(3.5)
113(36.3)
68(21.9)
38(12.2)
16(5.1)
0
1(0.3)
5(1.6)
1(0.3)
0
0
0
0
0
0
なお、本剤+イピリムマブ群において神経障害86例(27.5%)、肝機能障害102例
(32.6%)、甲状腺機能障害87例(27.8%)、腎機能障害21例(6.7%)、間質性肺疾患25
例(8.0%)、大腸炎・重度の下痢60例(19.2%)、重度の皮膚障害21例(6.7%)、下垂
体機能障害27例(8.6%)、副腎機能障害14例(4.5%)、膵炎3例(1.0%)、脳炎・髄膜
炎2例(0.6%)、infusion reaction 13例(4.2%)、ぶどう膜炎3例(1.0%)、筋炎3例(1.0%)、
横紋筋融解症/ミオパチー50例(16.0%)、肝炎14例(4.5%)及び静脈血栓塞栓症2例(0.6%)
が認められた。また、1型糖尿病、重症筋無力症、心筋炎及び免疫性血小板減少性紫斑
病は認められなかった。本剤群において神経障害66例(21.1%)、肝機能障害24例(7.7%)、
甲状腺機能障害47例(15.0%)、腎機能障害3例(1.0%)、間質性肺疾患5例(1.6%)、
大腸炎・重度の下痢16例(5.1%)、重度の皮膚障害8例(2.6%)、下垂体機能障害3例(1.0%)、
副腎機能障害3例(1.0%)、膵炎3例(1.0%)、infusion reaction 14例(4.5%)、ぶどう膜
炎2例(0.6%)、横紋筋融解症/ミオパチー28例(8.9%)、肝炎2例(0.6%)及び静脈血
栓塞栓症1例(0.3%)が認められた。また、1型糖尿病、重症筋無力症、脳炎・髄膜炎、
心筋炎、筋炎及び免疫性血小板減少性紫斑病は認められなかった。本副作用発現状況は
関連事象(臨床検査値異常を含む)を含む集計結果を示す。
根治切除不能な悪性黒色腫患者を対象に本剤+イピリムマブ投与を検討した海外第
Ⅰ相試験(CA209004 試験)のコホート 8 において、化学療法未治療患者 28 例と化学療
法既治療患者 13 例との間で、安全性に明確な差異は認められなかった。
16