よむ、つかう、まなぶ。
資料1-2 早期導入を要望する医療機器等に関する要望書【No.2024-2】 (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_54222.html |
| 出典情報 | 医療ニーズの高い医療機器等の早期導入に関する検討会(第39回 3/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(別添様式1)
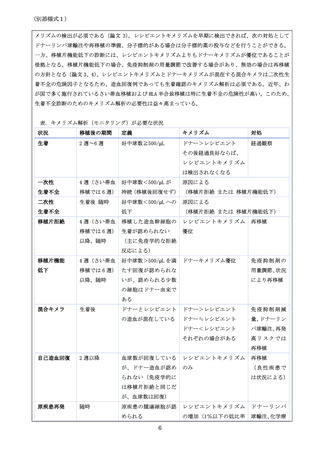
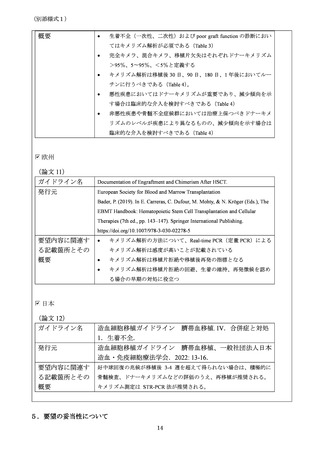
【要件を設定する際に考慮すべき点】
・移植施設認定基準(カテゴリー1、2、または 3)を満たす。
6-2. 使用する医師への要件
必要
不要
【必要/不要と思われる理由】
造血幹細胞移植の施設要件を満たす必要があるが、医師への要件は不要である。KMR 法に
よる検査自体については方法が標準化され、欧州では承認されているキットを用いる。
このキットを扱うための特別な要件は不要である。
【要件を設定する際に考慮すべき点】
KMR 法による検査は方法が標準化されているが、一般的な組織適合検査、輸血検査に習
熟した臨床検査技師(日本輸血・細胞治療学会の認定輸血検査技師、または日本組織適
合性学会の認定 HLA 検査技術者など)が勤務する施設において行う必要がある(下記 6-6
を参照のこと)。
6-3. 研修・トレーニング
必要
不要
【必要/不要と思われる理由】
【要件を設定する際に考慮すべき点】
6-4. 診療ガイドラインの策定
必要
不要
【必要/不要と思われる理由】
日本のガイドラインにおいて、さい帯血移植の生着不全に記載があるが、他の移植ソー
スについてのガイドラインには記載が無い。また、移植後再発におけるキメリズム解析
の役割についてもガイドラインへの記載が必要である。
【要件を設定する際に考慮すべき点】
以上は、KMR キットを用いたキメリズム解析にとどまらず、全てのキメリズム解析におい
て必要な記載になる。
6-5.
学会による使用症例の収集
16
【要件を設定する際に考慮すべき点】
・移植施設認定基準(カテゴリー1、2、または 3)を満たす。
6-2. 使用する医師への要件
必要
不要
【必要/不要と思われる理由】
造血幹細胞移植の施設要件を満たす必要があるが、医師への要件は不要である。KMR 法に
よる検査自体については方法が標準化され、欧州では承認されているキットを用いる。
このキットを扱うための特別な要件は不要である。
【要件を設定する際に考慮すべき点】
KMR 法による検査は方法が標準化されているが、一般的な組織適合検査、輸血検査に習
熟した臨床検査技師(日本輸血・細胞治療学会の認定輸血検査技師、または日本組織適
合性学会の認定 HLA 検査技術者など)が勤務する施設において行う必要がある(下記 6-6
を参照のこと)。
6-3. 研修・トレーニング
必要
不要
【必要/不要と思われる理由】
【要件を設定する際に考慮すべき点】
6-4. 診療ガイドラインの策定
必要
不要
【必要/不要と思われる理由】
日本のガイドラインにおいて、さい帯血移植の生着不全に記載があるが、他の移植ソー
スについてのガイドラインには記載が無い。また、移植後再発におけるキメリズム解析
の役割についてもガイドラインへの記載が必要である。
【要件を設定する際に考慮すべき点】
以上は、KMR キットを用いたキメリズム解析にとどまらず、全てのキメリズム解析におい
て必要な記載になる。
6-5.
学会による使用症例の収集
16