よむ、つかう、まなぶ。
資料1-2 早期導入を要望する医療機器等に関する要望書【No.2024-2】 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_54222.html |
| 出典情報 | 医療ニーズの高い医療機器等の早期導入に関する検討会(第39回 3/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
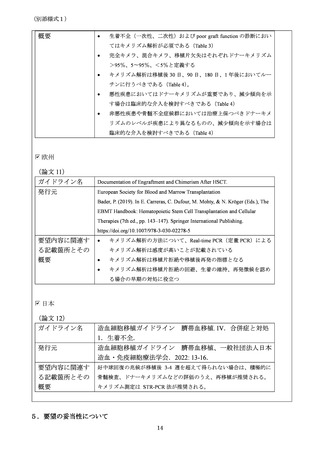
(別添様式1)
の DNA であっても正確に検査が可能である(10ng の DNA において 0.3%のレシピ
エントキメリズムを正確に検出できる)。
有
無
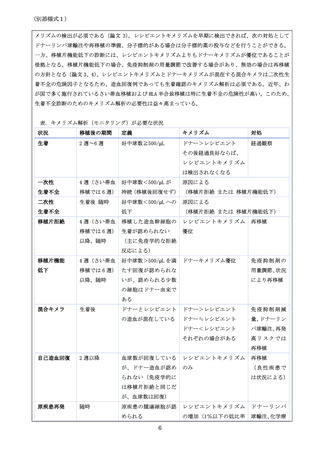
【類似医療機器の概要】
(類似医療機器がある場合は、該当する製品ごとにすべて記載し
国内における
類似医療機器
てください。)
製品名
承認番号
企業名
要望品目との違い
2-3. 海外での承認状況
米国
承認年月日
PMA / 510K / HDE
Number
承認されている適
応の内容
(対象疾患、対象部位、使用目的等について記載してください。
)
欧州
CE マーク年月日
2020 年 10 月 1 日
承認されている適
応の内容
同種造血幹細胞移植後、全患者を対象とする、キメリズム解析
(資料 1)
欧米未承認
①
優れた試験成績が論文等で公表されているもの
②
医師主導治験を実施中または終了したもの
③
先進医療Bで一定の実績があるもの
(上記に該当すると考えた根拠を記載してください。①又は③に該当する場合は、根拠となる公
表論文等を必ず記載してください。
)
2-4. 国内の承認内容
4
の DNA であっても正確に検査が可能である(10ng の DNA において 0.3%のレシピ
エントキメリズムを正確に検出できる)。
有
無
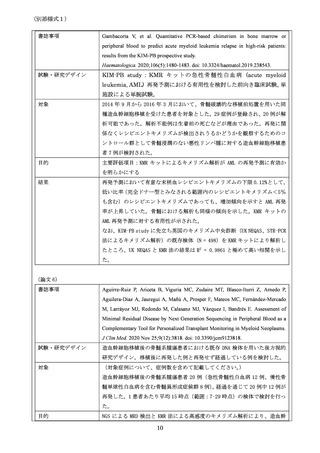
【類似医療機器の概要】
(類似医療機器がある場合は、該当する製品ごとにすべて記載し
国内における
類似医療機器
てください。)
製品名
承認番号
企業名
要望品目との違い
2-3. 海外での承認状況
米国
承認年月日
PMA / 510K / HDE
Number
承認されている適
応の内容
(対象疾患、対象部位、使用目的等について記載してください。
)
欧州
CE マーク年月日
2020 年 10 月 1 日
承認されている適
応の内容
同種造血幹細胞移植後、全患者を対象とする、キメリズム解析
(資料 1)
欧米未承認
①
優れた試験成績が論文等で公表されているもの
②
医師主導治験を実施中または終了したもの
③
先進医療Bで一定の実績があるもの
(上記に該当すると考えた根拠を記載してください。①又は③に該当する場合は、根拠となる公
表論文等を必ず記載してください。
)
2-4. 国内の承認内容
4