よむ、つかう、まなぶ。
参考資料8 「定期の予防接種等による副反応疑いの報告等の取扱いについて」の一部改正について(令和4年3月18日付け健発0318第19号・薬生発0318第13号厚生労働省健康局長及び医薬・生活衛生局長連名通知) (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00053.html |
| 出典情報 | 第87回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第16回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
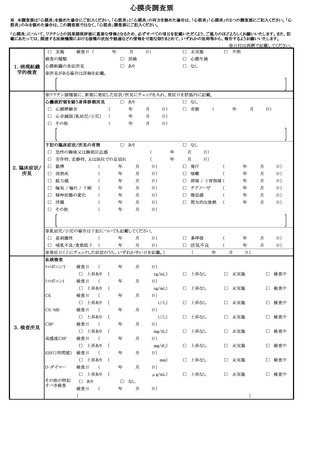
別紙
「定期の予防接種等による副反応疑いの報告等の取扱いについて」 新旧対照表
改
正 後
現
行
定期の予防接種等による副反応疑いの報告等の取扱いについて
(略)
記
定期の予防接種等による副反応疑いの報告等の取扱いについて
(略)
記
1 副反応疑い報告について
1 副反応疑い報告について
(略)
(略)
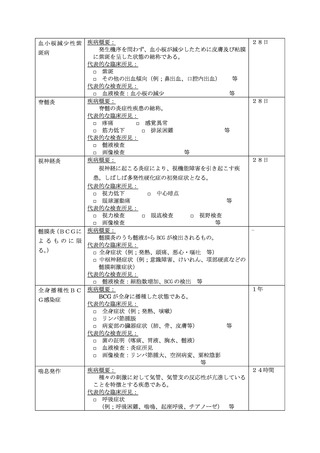
2 任意接種における健康被害の報告
都道府県及び市町村は、定期の予防接種以外の予防接種
(以下「任意接種」という。)のみを行う医療機関に対して
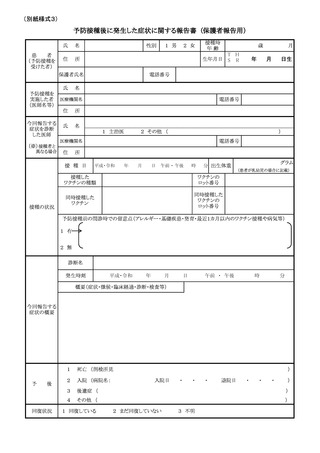
も、別紙様式1及び全種調査票を配布並びに別紙様式2を周
知し、当該報告への協力を求めること。任意接種における健
康被害については、「医薬関係者からの医薬品、医療機器、
再生医療等製品、医薬部外品及び化粧品の副作用、感染症及
び不具合報告の実施要領について」(令和4年3月 18 日付
け薬生発 0318 第1号)の別添「医薬品・医療機器等安全性
情報報告制度」実施要領の「(2)報告対象となる情報」に
該当する疾病、障害若しくは死亡の発生又は感染症の発生で
あり、医薬品、医療機器等の品質、有効性及び安全性の確保
等に関する法律第 68 条の 10 第2項の規定に基づき、薬局開
設者、病院若しくは診療所の開設者又は医師、歯科医師、薬
剤師その他医薬関係者は、保健衛生上の危害の発生又は拡大
を防止するため必要があると認めるとき(別記①~⑨参照)
は、1(1)と同様に、別紙様式1又は2を用い、速やかに
2 任意接種における健康被害の報告
都道府県及び市町村は、定期の予防接種以外の予防接種
(以下「任意接種」という。)のみを行う医療機関に対して
も、別紙様式1及び全種調査票を配布並びに別紙様式2を周
知し、当該報告への協力を求めること。任意接種における健
康被害については、「医療機関等からの医薬品又は医療機器
についての副作用、感染症及び不具合報告の実施要領の改訂
について」(平成 22 年7月 29 日付け薬食発 0729 第2号厚生
労働省医薬食品局長通知)の別添「医薬品・医療機器等安全
性情報報告制度」実施要領の「(2)報告対象となる情報」
に該当する疾病、障害若しくは死亡の発生又は感染症の発生
であり、医薬品、医療機器等の品質、有効性及び安全性の確
保等に関する法律第 68 条の 10 第2項の規定に基づき、薬局
開設者、病院若しくは診療所の開設者又は医師、歯科医師、
薬剤師その他医薬関係者は、保健衛生上の危害の発生又は拡
大を防止するため必要があると認めるとき(別記①~⑨参
照)は、1(1)と同様に、別紙様式1又は2を用い、速や
「定期の予防接種等による副反応疑いの報告等の取扱いについて」 新旧対照表
改
正 後
現
行
定期の予防接種等による副反応疑いの報告等の取扱いについて
(略)
記
定期の予防接種等による副反応疑いの報告等の取扱いについて
(略)
記
1 副反応疑い報告について
1 副反応疑い報告について
(略)
(略)
2 任意接種における健康被害の報告
都道府県及び市町村は、定期の予防接種以外の予防接種
(以下「任意接種」という。)のみを行う医療機関に対して
も、別紙様式1及び全種調査票を配布並びに別紙様式2を周
知し、当該報告への協力を求めること。任意接種における健
康被害については、「医薬関係者からの医薬品、医療機器、
再生医療等製品、医薬部外品及び化粧品の副作用、感染症及
び不具合報告の実施要領について」(令和4年3月 18 日付
け薬生発 0318 第1号)の別添「医薬品・医療機器等安全性
情報報告制度」実施要領の「(2)報告対象となる情報」に
該当する疾病、障害若しくは死亡の発生又は感染症の発生で
あり、医薬品、医療機器等の品質、有効性及び安全性の確保
等に関する法律第 68 条の 10 第2項の規定に基づき、薬局開
設者、病院若しくは診療所の開設者又は医師、歯科医師、薬
剤師その他医薬関係者は、保健衛生上の危害の発生又は拡大
を防止するため必要があると認めるとき(別記①~⑨参照)
は、1(1)と同様に、別紙様式1又は2を用い、速やかに
2 任意接種における健康被害の報告
都道府県及び市町村は、定期の予防接種以外の予防接種
(以下「任意接種」という。)のみを行う医療機関に対して
も、別紙様式1及び全種調査票を配布並びに別紙様式2を周
知し、当該報告への協力を求めること。任意接種における健
康被害については、「医療機関等からの医薬品又は医療機器
についての副作用、感染症及び不具合報告の実施要領の改訂
について」(平成 22 年7月 29 日付け薬食発 0729 第2号厚生
労働省医薬食品局長通知)の別添「医薬品・医療機器等安全
性情報報告制度」実施要領の「(2)報告対象となる情報」
に該当する疾病、障害若しくは死亡の発生又は感染症の発生
であり、医薬品、医療機器等の品質、有効性及び安全性の確
保等に関する法律第 68 条の 10 第2項の規定に基づき、薬局
開設者、病院若しくは診療所の開設者又は医師、歯科医師、
薬剤師その他医薬関係者は、保健衛生上の危害の発生又は拡
大を防止するため必要があると認めるとき(別記①~⑨参
照)は、1(1)と同様に、別紙様式1又は2を用い、速や