よむ、つかう、まなぶ。
【資料5-1】医薬品等行政評価・監視委員会における海外調査(個別医薬品の欧米での承認状況) (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
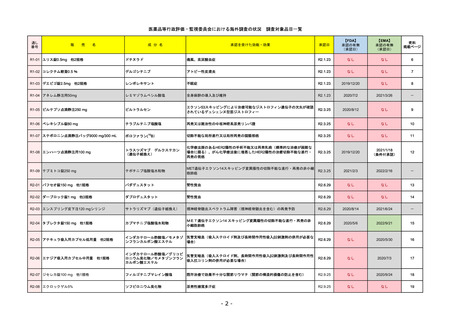
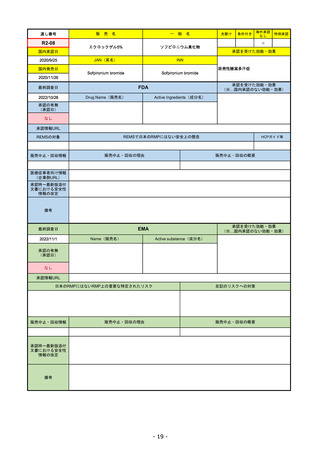
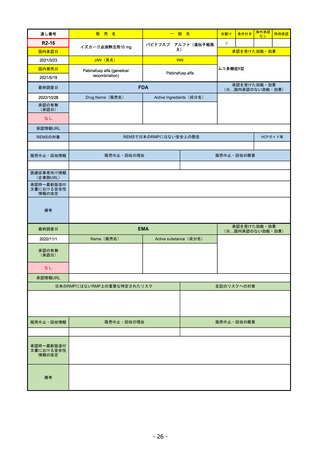
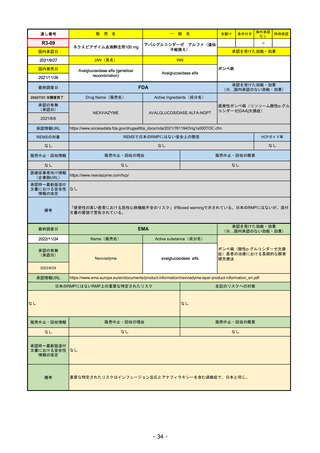
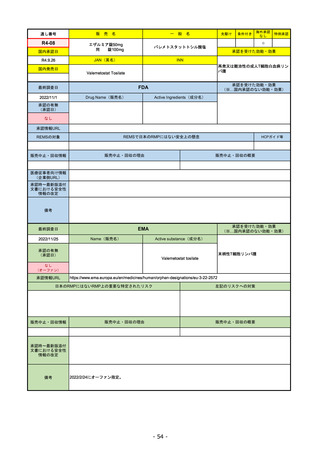
販
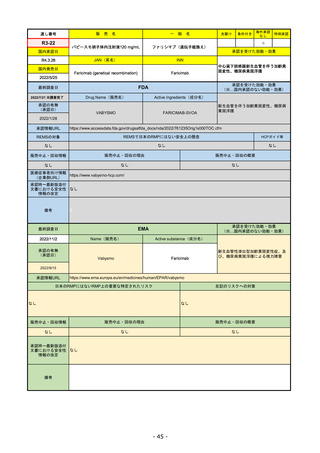
通し番号
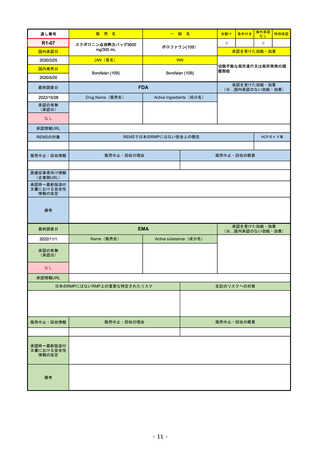
R1-08
売
名
一
エンハーツ点滴静注用100 mg
国内承認日
2020/3/25
国内発売日
般
名
条件付き
海外承認
なし
特例承認
0
○
0
0
トラスツズマブ デルクステカン(遺伝
子組換え)
JAN(英名)
INN
Trastuzumab deruxtecan
Trastuzumab deruxtecan
2020/5/25
承認を受けた効能・効果
化学療法歴のあるHER2陽性の手術不能
又は再発乳癌(標準的な治療が困難な
場合に限る)、がん化学療法後に増悪
したHER2陽性の治癒切除不能な進行・
再発の胃癌
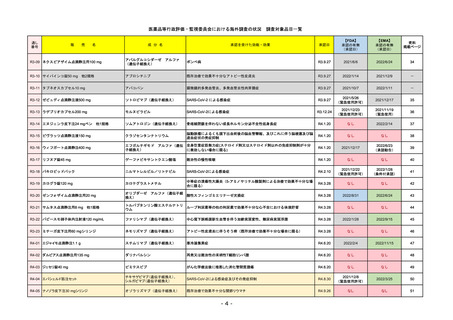
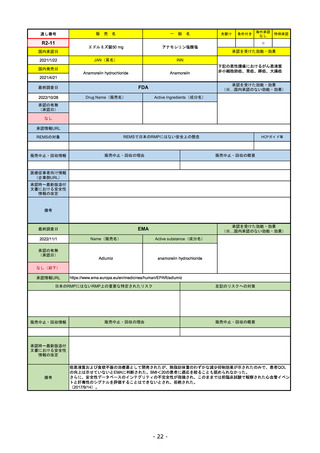
承認を受けた効能・効果
(※…国内承認のない効能・効果)
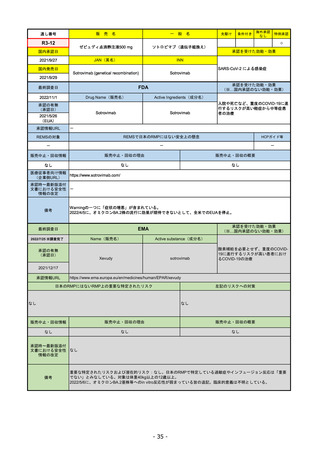
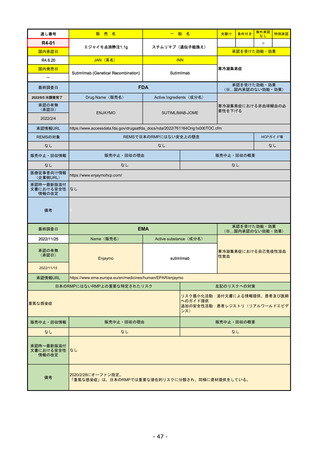
FDA
最終調査日
2022/8/4 ※調査完了
承認の有無
(承認日)
Drug Name(販売名)
Active Ingredients(成分名)
ENHERTU
FAM-TRASTUZUMAB DERUXTECANNXKI
2019/12/20
承認情報URL
先駆け
転移性で下記#いずれかの抗HER2ベースの治療を受けた、
切除不能または転移性のHER2陽性乳がん
(#転移性設定レジメン・(ネオ)アジュバント治療中または
治療終了後6カ月以内に再発)
トラスツズマブベースの治療を受けた、局所進行性または
転移性のHER2陽性胃がんまたは胃食道接合部腺がん
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2019/761139Orig1s000TOC.cfm
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
なし
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
https://www.enhertuhcp.com/en/
(企業側URL)
承認時~最新版添付 2021/1/15 胃がんが適応に加わり、有害作用の記述が用法ごとに分かれ、間質性肺炎や左心室機能障害の発生数もそれぞ
文書における安全性 れに記載されるようになった。乳がんで16種、胃がんで19種。
情報の改定
2022/05/04 制吐薬の予防投与が推奨。
当初は乳がんのみの適応だったが、用量の異なる胃がんが加わったことにより、有害作用欄も適応ごとに分けて表記される
ようになった。
乳がんの適応条件が2種の治療のいずれかの経験があることに緩められた。
Boxed warningで「胚・胎児毒性」が挙げられている。日本のRMPでは重要な潜在的リスク扱い。
備考
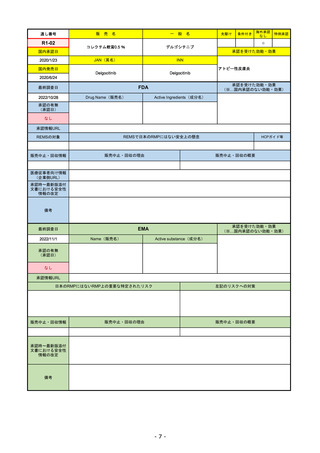
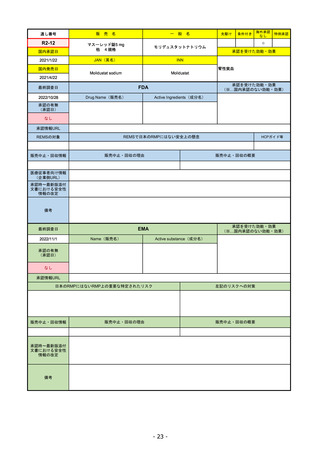
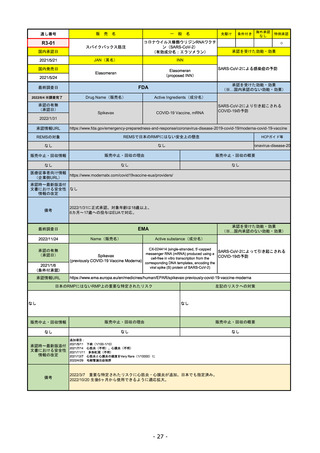
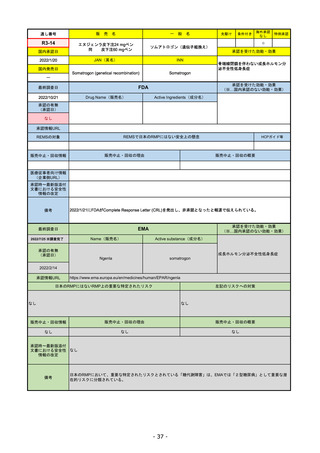
承認を受けた効能・効果
(※…国内承認のない効能・効果)
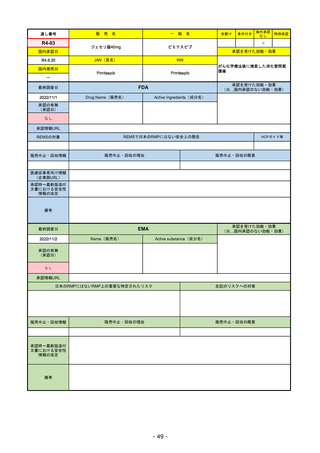
EMA
最終調査日
2022/11/24
承認の有無
(承認日)
Name(販売名)
Active substance(成分名)
Enhertu
trastuzumab deruxtecan
抗HER2ベースの治療を1種以上受けた
切除不能または転移性HER2陽性乳がん
2021/1/18
(条件付承認)
承認情報URL
https://www.ema.europa.eu/en/medicines/human/EPAR/enhertu
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
リスク最小化活動:添付文書による注意喚起
左室駆出率(LVEF)低下のモニタリング(Section 4.4)、
用量調整のガイダンス(Section 4.2)
左心室機能障害(Left Ventricular Dysfunction)
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付
文書における安全性 なし
情報の改定
備考
EMAでは今のところ乳がんのみの適応。重要な特定されたリスクとしては、日本と同じく間質性肺炎が筆頭。左心室機能
障害は、日本のRMPでは重要な潜在的リスク扱い。
2022/8/1 使用要件としての「2種以上の前治療」が「1種以上」に緩和された。
2022/8/25 吐気・嘔吐の防止のため、2~3種の医薬品による前処置が求められた。
- 12 -
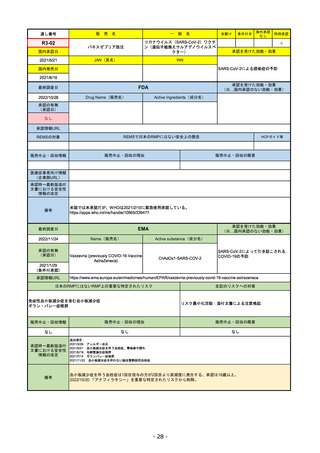
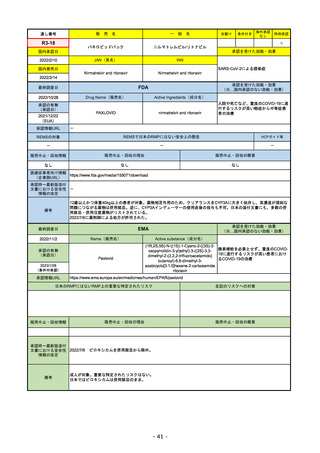
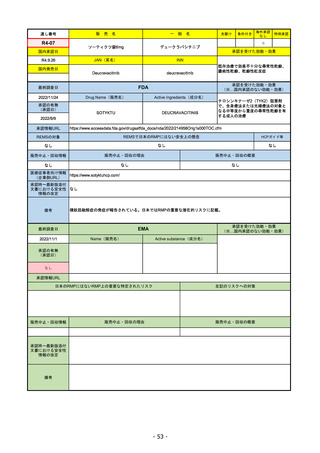
通し番号
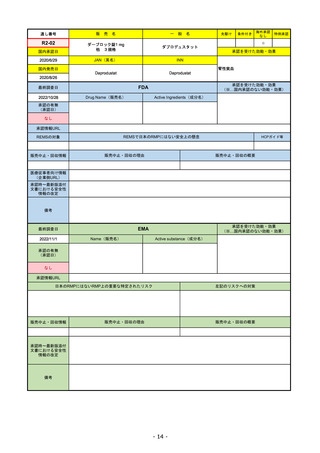
R1-08
売
名
一
エンハーツ点滴静注用100 mg
国内承認日
2020/3/25
国内発売日
般
名
条件付き
海外承認
なし
特例承認
0
○
0
0
トラスツズマブ デルクステカン(遺伝
子組換え)
JAN(英名)
INN
Trastuzumab deruxtecan
Trastuzumab deruxtecan
2020/5/25
承認を受けた効能・効果
化学療法歴のあるHER2陽性の手術不能
又は再発乳癌(標準的な治療が困難な
場合に限る)、がん化学療法後に増悪
したHER2陽性の治癒切除不能な進行・
再発の胃癌
承認を受けた効能・効果
(※…国内承認のない効能・効果)
FDA
最終調査日
2022/8/4 ※調査完了
承認の有無
(承認日)
Drug Name(販売名)
Active Ingredients(成分名)
ENHERTU
FAM-TRASTUZUMAB DERUXTECANNXKI
2019/12/20
承認情報URL
先駆け
転移性で下記#いずれかの抗HER2ベースの治療を受けた、
切除不能または転移性のHER2陽性乳がん
(#転移性設定レジメン・(ネオ)アジュバント治療中または
治療終了後6カ月以内に再発)
トラスツズマブベースの治療を受けた、局所進行性または
転移性のHER2陽性胃がんまたは胃食道接合部腺がん
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2019/761139Orig1s000TOC.cfm
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
なし
なし
なし
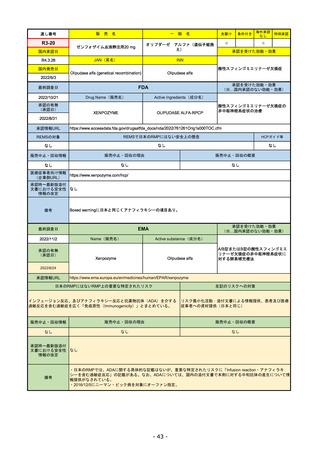
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
https://www.enhertuhcp.com/en/
(企業側URL)
承認時~最新版添付 2021/1/15 胃がんが適応に加わり、有害作用の記述が用法ごとに分かれ、間質性肺炎や左心室機能障害の発生数もそれぞ
文書における安全性 れに記載されるようになった。乳がんで16種、胃がんで19種。
情報の改定
2022/05/04 制吐薬の予防投与が推奨。
当初は乳がんのみの適応だったが、用量の異なる胃がんが加わったことにより、有害作用欄も適応ごとに分けて表記される
ようになった。
乳がんの適応条件が2種の治療のいずれかの経験があることに緩められた。
Boxed warningで「胚・胎児毒性」が挙げられている。日本のRMPでは重要な潜在的リスク扱い。
備考
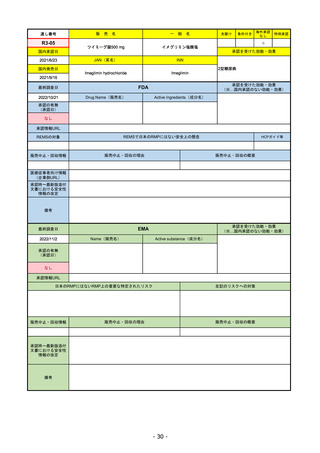
承認を受けた効能・効果
(※…国内承認のない効能・効果)
EMA
最終調査日
2022/11/24
承認の有無
(承認日)
Name(販売名)
Active substance(成分名)
Enhertu
trastuzumab deruxtecan
抗HER2ベースの治療を1種以上受けた
切除不能または転移性HER2陽性乳がん
2021/1/18
(条件付承認)
承認情報URL
https://www.ema.europa.eu/en/medicines/human/EPAR/enhertu
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
リスク最小化活動:添付文書による注意喚起
左室駆出率(LVEF)低下のモニタリング(Section 4.4)、
用量調整のガイダンス(Section 4.2)
左心室機能障害(Left Ventricular Dysfunction)
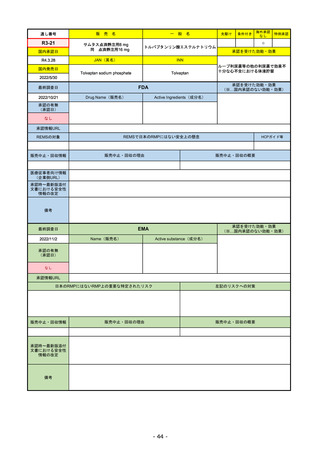
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付
文書における安全性 なし
情報の改定
備考
EMAでは今のところ乳がんのみの適応。重要な特定されたリスクとしては、日本と同じく間質性肺炎が筆頭。左心室機能
障害は、日本のRMPでは重要な潜在的リスク扱い。
2022/8/1 使用要件としての「2種以上の前治療」が「1種以上」に緩和された。
2022/8/25 吐気・嘔吐の防止のため、2~3種の医薬品による前処置が求められた。
- 12 -