よむ、つかう、まなぶ。
【資料5-1】医薬品等行政評価・監視委員会における海外調査(個別医薬品の欧米での承認状況) (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
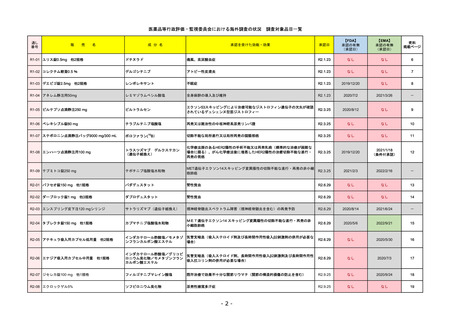
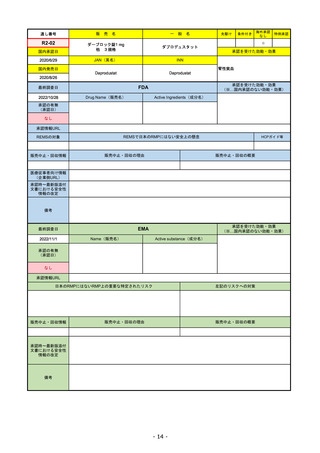
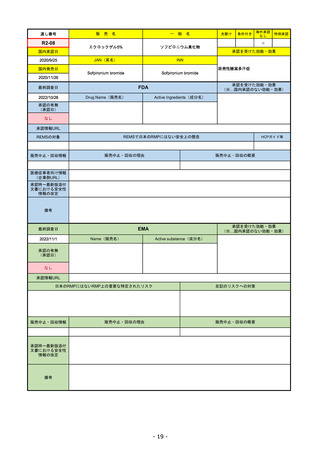
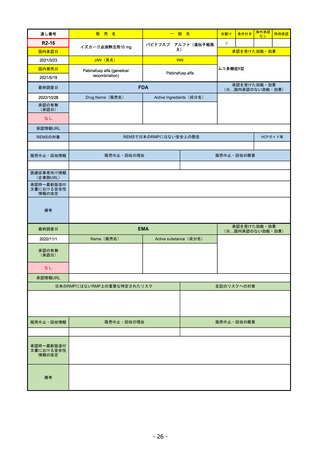
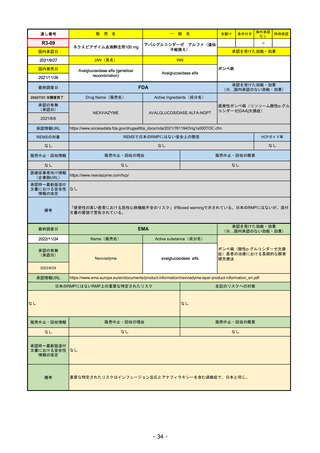
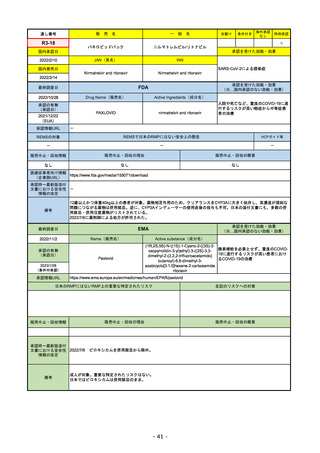
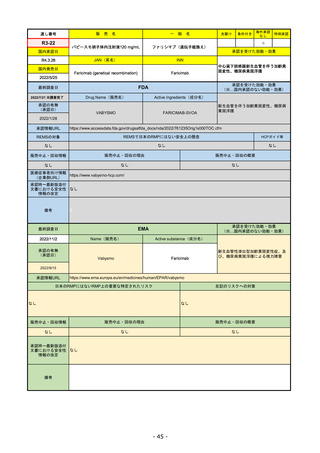
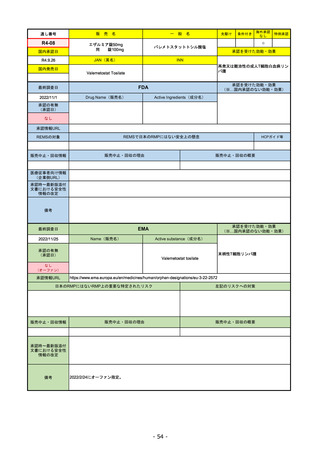
販
通し番号
R2-14
売
名
一
国内承認日
国内発売日
名
コロナウイルス修飾ウリジンRNAワクチ
ン(SARS-CoV-2)
(有効成分名:トジナメラン)
コミナティ筋注
2021/2/14
般
JAN(英名)
INN
Tozinameran
Tozinameran
先駆け
条件付き
海外承認
なし
特例承認
0
0
0
○
承認を受けた効能・効果
SARS-CoV-2による感染症の予防
2021/2/16
承認を受けた効能・効果
(※…国内承認のない効能・効果)
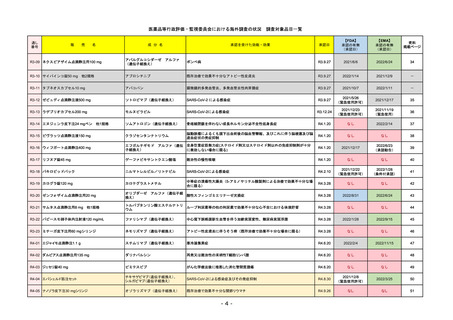
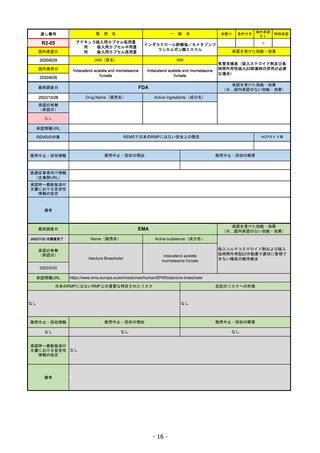
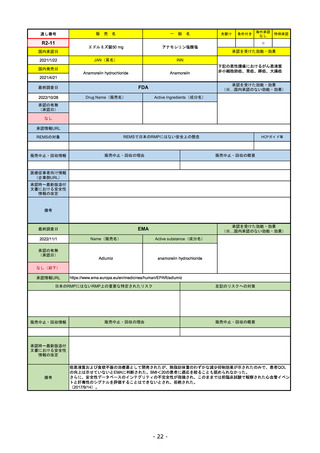
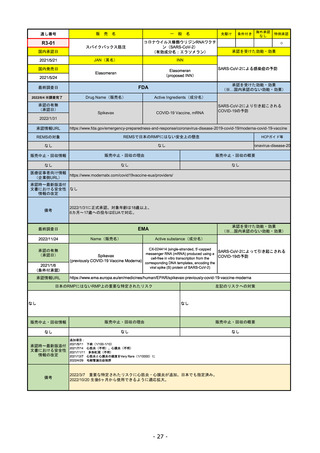
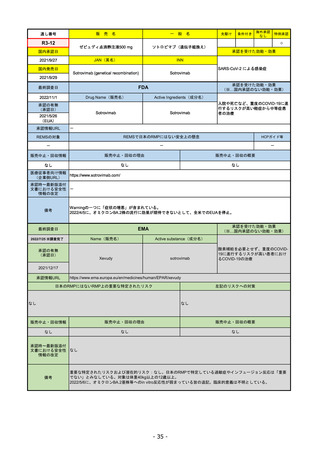
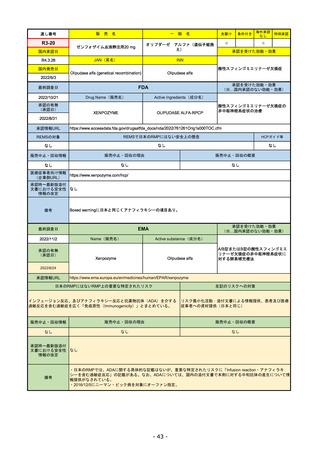
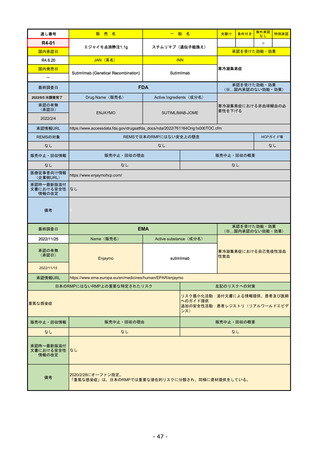
FDA
最終調査日
Drug Name(販売名)
2022/8/4 ※調査完了
承認の有無
(承認日)
Active Ingredients(成分名)
Comirnaty
COVID-19 Vaccine, mRNA
SARS-CoV-2により引き起こされる
COVID-19の予防
2021/8/23
承認情報URL
https://www.fda.gov/vaccines-blood-biologics/comirnaty
REMSで日本のRMPにはない安全上の懸念
REMSの対象
HCPガイド等
https://www.fda.gov/emergency-preparedness-and-response/coronavirus-disease-2019-covid-19/comirna
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
http://labeling.pfizer.com/ShowLabeling.aspx?id=14471
(企業側URL)
承認時~最新版添付
文書における安全性 なし
情報の改定
2022/5/17 単回ブースター接種を5~11歳へ拡大するEUA。
2022/6/17 3回のプライマリーシリーズ接種を6カ月~4歳へ拡大するEUA。
2022/7/8 12~15歳へ追加承認。これにより、12歳以上については通常承認となった。
備考
2022/11/24
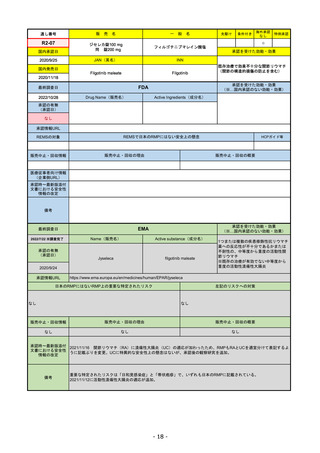
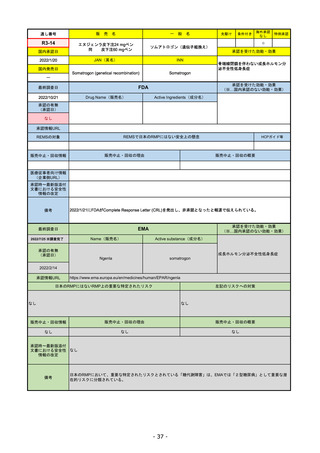
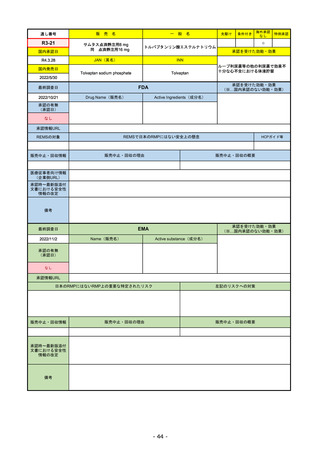
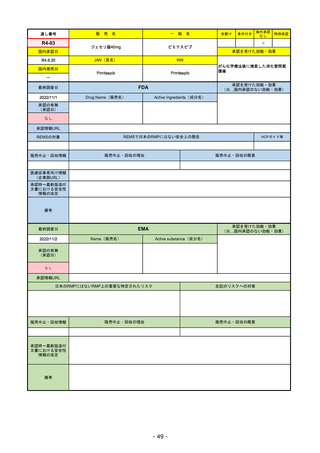
承認の有無
(承認日)
Name(販売名)
Active substance(成分名)
Single-stranded, 5’-capped messenger
RNA produced using a cell-free in vitro SARS-CoV-2によって引き起こされる
COVID-19の予防
transcription from the corresponding
DNA templates, encoding the viral spike
(S) protein of SARS-CoV-2
Comirnaty
2020/12/21
(条件付承認)
承認情報URL
承認を受けた効能・効果
(※…国内承認のない効能・効果)
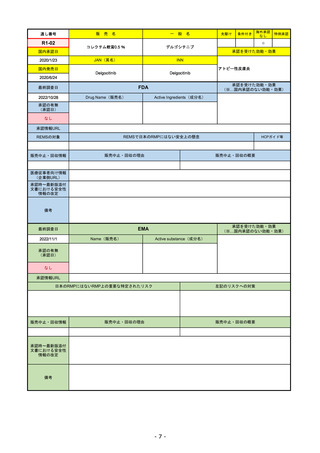
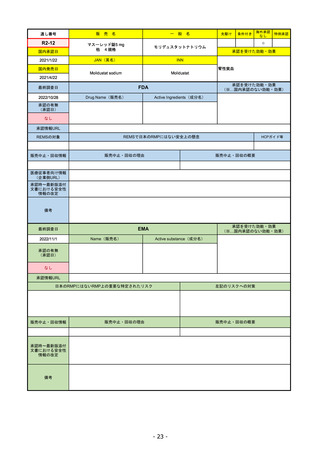
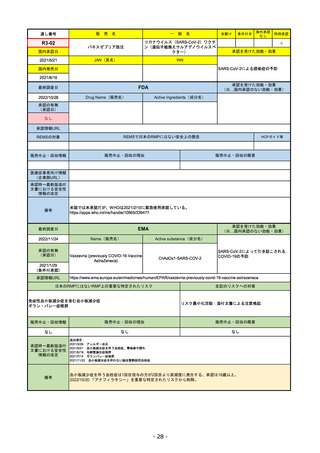
EMA
最終調査日
https://www.ema.europa.eu/en/medicines/human/EPAR/comirnaty
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付
文書における安全性
情報の改定
備考
追加項目:
2021/3/4 下痢、嘔吐
2021/3/29 接種上腕部の極度な腫れ
2021/4/14 皮膚アレルギー反応
2021/5/11 顔の腫れ
2021/7/14 心筋炎、心膜炎(不明)
2021/9/16 多汗症、寝汗、食欲不振、無力症および倦怠感
2021/11/18 多形紅斑(不明)
2021/12/7 心筋炎と心膜炎の頻度を「不明」から「Very Rare(1/10000)」に
2022/1/13 「ひりひりする痛み」を削除し、知覚異常・感覚鈍麻(不明)を追加
重要な特定されたリスクはアナフィラキシー及び心筋炎・心膜炎で日本と同じ。
2022/2/28に、妊婦や授乳婦も使用できることが明記された。日本は「有益性が危険性を上回ると判断される場合にのみ接種」「授乳の継続又は中止を検討すること」などとされてい
る。
2022/9/1にOmicron BA.1、同9/12に BA.4-5を成分に追加。
2022/10/20 3μg/回を生後6ヶ月から使用できるように適応拡大。
2022/11/10 PRACにより過多月経の副反応を監視するため、医療従事者等に接種後の月経障害に関する症例報告を推奨している。
- 24 -
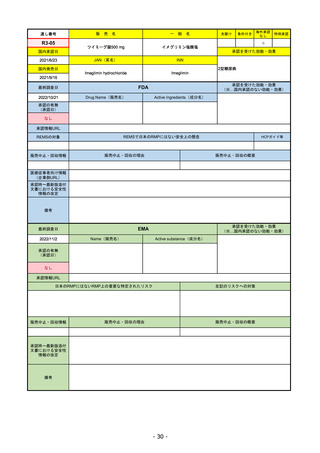
通し番号
R2-14
売
名
一
国内承認日
国内発売日
名
コロナウイルス修飾ウリジンRNAワクチ
ン(SARS-CoV-2)
(有効成分名:トジナメラン)
コミナティ筋注
2021/2/14
般
JAN(英名)
INN
Tozinameran
Tozinameran
先駆け
条件付き
海外承認
なし
特例承認
0
0
0
○
承認を受けた効能・効果
SARS-CoV-2による感染症の予防
2021/2/16
承認を受けた効能・効果
(※…国内承認のない効能・効果)
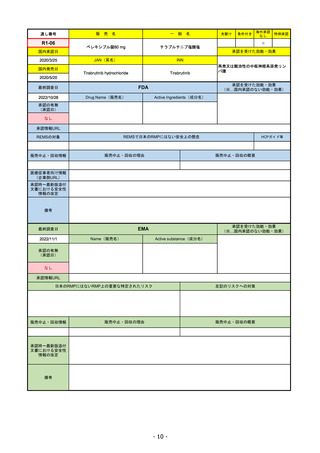
FDA
最終調査日
Drug Name(販売名)
2022/8/4 ※調査完了
承認の有無
(承認日)
Active Ingredients(成分名)
Comirnaty
COVID-19 Vaccine, mRNA
SARS-CoV-2により引き起こされる
COVID-19の予防
2021/8/23
承認情報URL
https://www.fda.gov/vaccines-blood-biologics/comirnaty
REMSで日本のRMPにはない安全上の懸念
REMSの対象
HCPガイド等
https://www.fda.gov/emergency-preparedness-and-response/coronavirus-disease-2019-covid-19/comirna
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
http://labeling.pfizer.com/ShowLabeling.aspx?id=14471
(企業側URL)
承認時~最新版添付
文書における安全性 なし
情報の改定
2022/5/17 単回ブースター接種を5~11歳へ拡大するEUA。
2022/6/17 3回のプライマリーシリーズ接種を6カ月~4歳へ拡大するEUA。
2022/7/8 12~15歳へ追加承認。これにより、12歳以上については通常承認となった。
備考
2022/11/24
承認の有無
(承認日)
Name(販売名)
Active substance(成分名)
Single-stranded, 5’-capped messenger
RNA produced using a cell-free in vitro SARS-CoV-2によって引き起こされる
COVID-19の予防
transcription from the corresponding
DNA templates, encoding the viral spike
(S) protein of SARS-CoV-2
Comirnaty
2020/12/21
(条件付承認)
承認情報URL
承認を受けた効能・効果
(※…国内承認のない効能・効果)
EMA
最終調査日
https://www.ema.europa.eu/en/medicines/human/EPAR/comirnaty
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付
文書における安全性
情報の改定
備考
追加項目:
2021/3/4 下痢、嘔吐
2021/3/29 接種上腕部の極度な腫れ
2021/4/14 皮膚アレルギー反応
2021/5/11 顔の腫れ
2021/7/14 心筋炎、心膜炎(不明)
2021/9/16 多汗症、寝汗、食欲不振、無力症および倦怠感
2021/11/18 多形紅斑(不明)
2021/12/7 心筋炎と心膜炎の頻度を「不明」から「Very Rare(1/10000)」に
2022/1/13 「ひりひりする痛み」を削除し、知覚異常・感覚鈍麻(不明)を追加
重要な特定されたリスクはアナフィラキシー及び心筋炎・心膜炎で日本と同じ。
2022/2/28に、妊婦や授乳婦も使用できることが明記された。日本は「有益性が危険性を上回ると判断される場合にのみ接種」「授乳の継続又は中止を検討すること」などとされてい
る。
2022/9/1にOmicron BA.1、同9/12に BA.4-5を成分に追加。
2022/10/20 3μg/回を生後6ヶ月から使用できるように適応拡大。
2022/11/10 PRACにより過多月経の副反応を監視するため、医療従事者等に接種後の月経障害に関する症例報告を推奨している。
- 24 -