よむ、つかう、まなぶ。
別紙1 (32 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00042.html |
| 出典情報 | 先進医療会議(第108回先進医療会議、第129回先進医療技術審査部会 3/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【別添6】
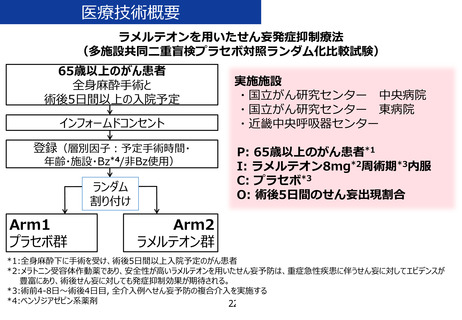
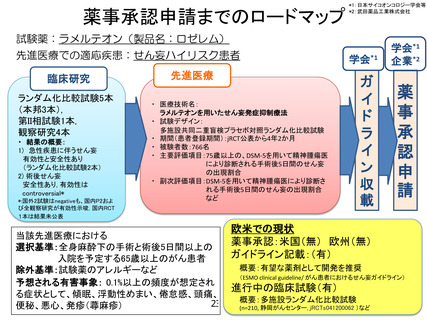
「ラメルテオンを用いたせん妄発症抑制療法」の治療計画(申請書類
より抜粋)
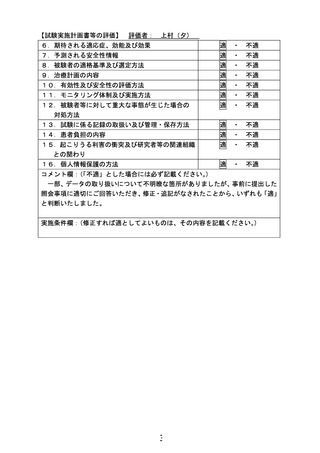
6.治療計画
試験薬(ラメルテオンもしくはプラセボ)を 1 日 1 回 1 錠(8mg)、手術 4-8 日前から術後
4 日目まで就寝前に経口もしくは経鼻胃管から投与する。
1.
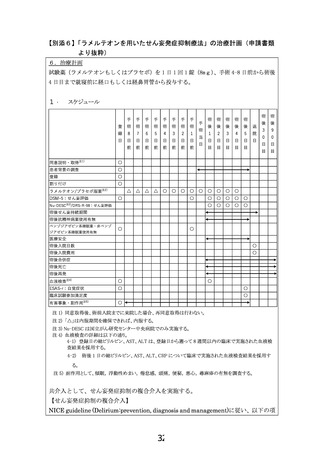
スケジュール
手
手
手
手
手
手
手
手
登
術
術
術
術
術
術
術
術
録
8
7
6
5
4
3
2
1
日
日
日
日
日
日
日
日
日
前
前
前
前
前
前
前
前
△
△
△
△
〇
〇
〇
〇
同意説明・取得注1)
〇
患者背景の調査
〇
登録
〇
割り付け
〇
ラメルテオン/プラセボ服薬注2)
DSM-5:せん妄評価
Nu-DESC
〇
手
術
当
日
〇
〇
注2)
/DRS-R-98:せん妄評価
術
術
術
術
術
後
後
後
後
後
退
1
2
3
4
5
院
日
日
日
日
日
日
目
目
目
目
目
〇
〇
〇
〇
〇
〇
〇
〇
〇
〇
〇
〇
〇
〇
術
術
後
後
3
9
0
0
日
日
目
目
術後せん妄持続期間
術後抗精神病薬使用有無
ベンゾジアゼピン系睡眠薬・非ベンゾ
ジアゼピン系睡眠薬使用有無
〇
〇
医療安全
術後入院日数
〇
術後入院費用
〇
術後合併症
術後死亡
術後再発
血液検査注4)
〇
ESAS-r:自覚症状
〇
〇
〇
臨床試験参加満足度
注5)
有害事象・副作用
〇
〇
注 1) 同意取得後、術前入院までに来院した場合、再同意取得は行わない。
注 2) 「△」は内服期間を確保できれば、内服する。
注 3) Nu-DESC は国立がん研究センター中央病院でのみ実施する。
注 4) 血液検査の詳細は以下の通り。
4-1) 登録日の総ビリルビン、AST、ALT は、登録日から遡って 8 週間以内の臨床で実施された血液検
査結果を採用する。
4-2)
術後 1 日の総ビリルビン、AST、ALT、CRP について臨床で実施された血液検査結果を採用す
る。
注 5) 副作用として、傾眠, 浮動性めまい, 倦怠感, 頭痛, 便秘, 悪心, 蕁麻疹の有無を調査する。
共介入として、せん妄発症抑制の複合介入を実施する。
【せん妄発症抑制の複合介入】
NICE guideline (Delirium:prevention, diagnosis and management)に従い、以下の項
32
「ラメルテオンを用いたせん妄発症抑制療法」の治療計画(申請書類
より抜粋)
6.治療計画
試験薬(ラメルテオンもしくはプラセボ)を 1 日 1 回 1 錠(8mg)、手術 4-8 日前から術後
4 日目まで就寝前に経口もしくは経鼻胃管から投与する。
1.
スケジュール
手
手
手
手
手
手
手
手
登
術
術
術
術
術
術
術
術
録
8
7
6
5
4
3
2
1
日
日
日
日
日
日
日
日
日
前
前
前
前
前
前
前
前
△
△
△
△
〇
〇
〇
〇
同意説明・取得注1)
〇
患者背景の調査
〇
登録
〇
割り付け
〇
ラメルテオン/プラセボ服薬注2)
DSM-5:せん妄評価
Nu-DESC
〇
手
術
当
日
〇
〇
注2)
/DRS-R-98:せん妄評価
術
術
術
術
術
後
後
後
後
後
退
1
2
3
4
5
院
日
日
日
日
日
日
目
目
目
目
目
〇
〇
〇
〇
〇
〇
〇
〇
〇
〇
〇
〇
〇
〇
術
術
後
後
3
9
0
0
日
日
目
目
術後せん妄持続期間
術後抗精神病薬使用有無
ベンゾジアゼピン系睡眠薬・非ベンゾ
ジアゼピン系睡眠薬使用有無
〇
〇
医療安全
術後入院日数
〇
術後入院費用
〇
術後合併症
術後死亡
術後再発
血液検査注4)
〇
ESAS-r:自覚症状
〇
〇
〇
臨床試験参加満足度
注5)
有害事象・副作用
〇
〇
注 1) 同意取得後、術前入院までに来院した場合、再同意取得は行わない。
注 2) 「△」は内服期間を確保できれば、内服する。
注 3) Nu-DESC は国立がん研究センター中央病院でのみ実施する。
注 4) 血液検査の詳細は以下の通り。
4-1) 登録日の総ビリルビン、AST、ALT は、登録日から遡って 8 週間以内の臨床で実施された血液検
査結果を採用する。
4-2)
術後 1 日の総ビリルビン、AST、ALT、CRP について臨床で実施された血液検査結果を採用す
る。
注 5) 副作用として、傾眠, 浮動性めまい, 倦怠感, 頭痛, 便秘, 悪心, 蕁麻疹の有無を調査する。
共介入として、せん妄発症抑制の複合介入を実施する。
【せん妄発症抑制の複合介入】
NICE guideline (Delirium:prevention, diagnosis and management)に従い、以下の項
32