よむ、つかう、まなぶ。
【資料4】医薬品等行政評価・監視委員会における海外調査 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33889.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第12回 6/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
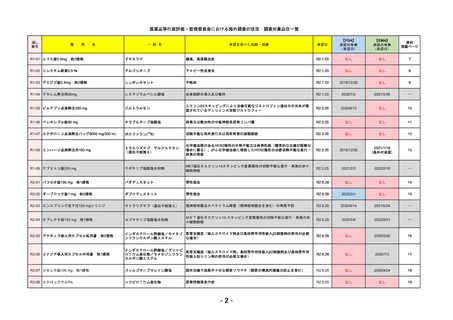
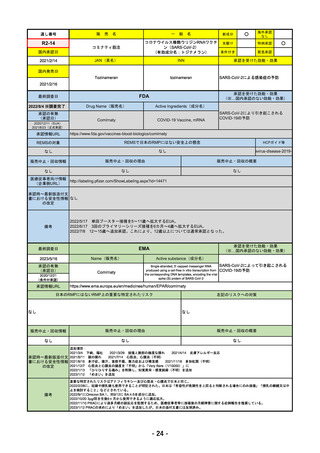
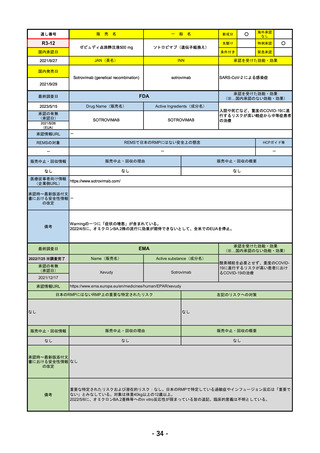
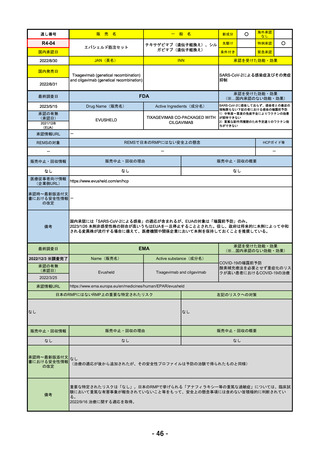
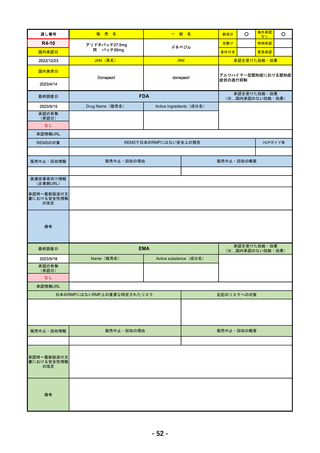
医薬品等行政評価・監視委員会における海外調査の状況 調査対象品目一覧
通し
番号
販
売
一 般 名
名
承認を受けた効能・効果
承認日
【FDA】
承認の有無
(承認日)
【EMA】
承認の有無
(承認日)
資料
掲載ページ
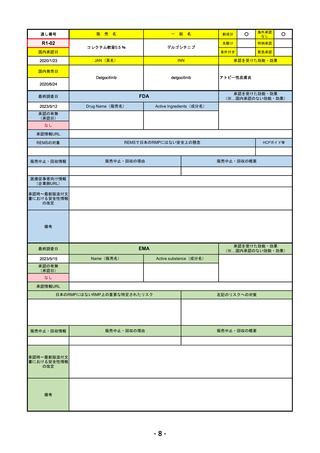
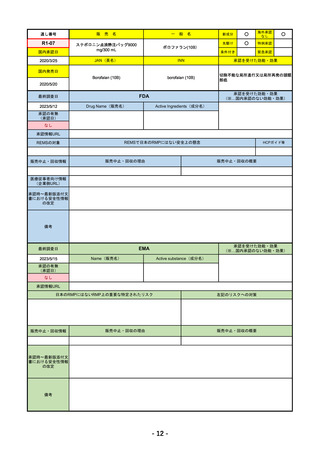
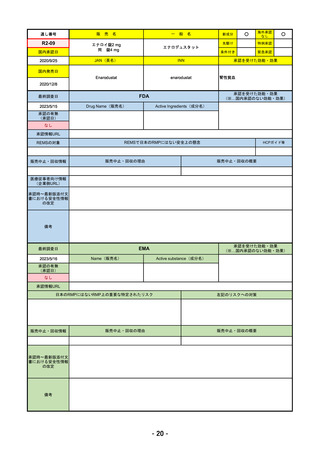
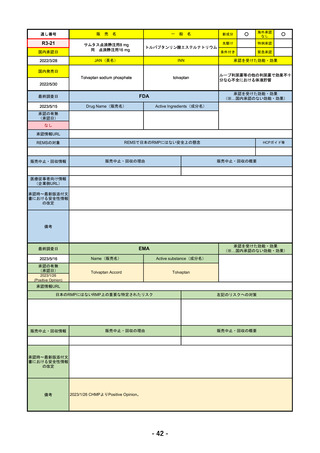
R4-05 ナノゾラ皮下注30 mgシリンジ
オゾラリズマブ(遺伝子組換え)
既存治療で効果不十分な関節リウマチ
R4.9.26
なし
なし
47
R4-06 スぺビゴ点滴静注450mg
スペソリマブ(遺伝子組換え)
膿疱性乾癬における急性症状の改善
R4.9.26
2022/9/1
2022/12/9
(条件付承認)
48
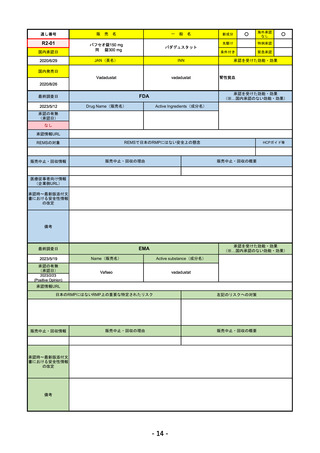
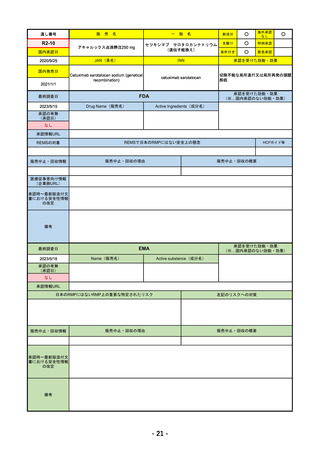
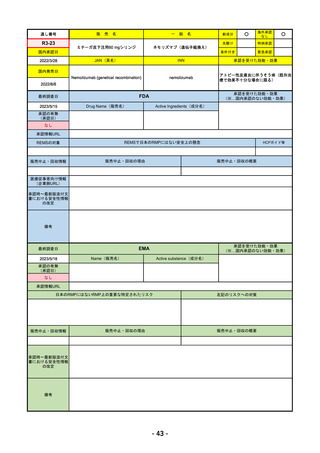
R4-07 ソーティクツ錠6mg
デュークラバシチニブ
既存治療で効果不十分な尋常性乾癬、膿疱性乾癬、乾癬性紅皮症
R4.9.26
2022/9/9
2023/3/24
49
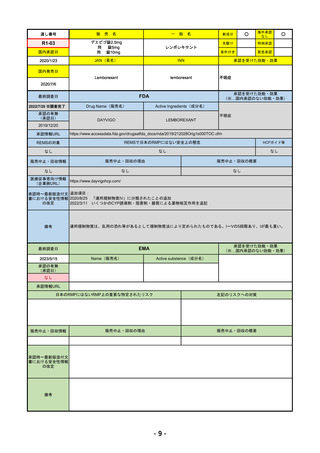
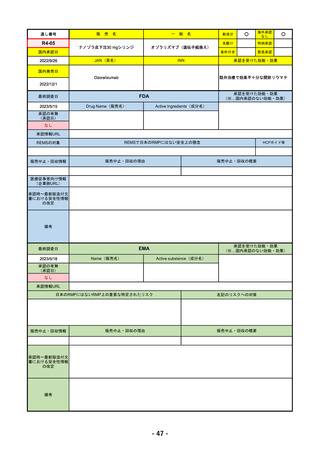
R4-08 エザルミア錠50mg 他1規格
バレメトスタットトシル酸塩
再発又は難治性の成人T細胞白血病リンパ腫
R4.9.26
なし
なし
50
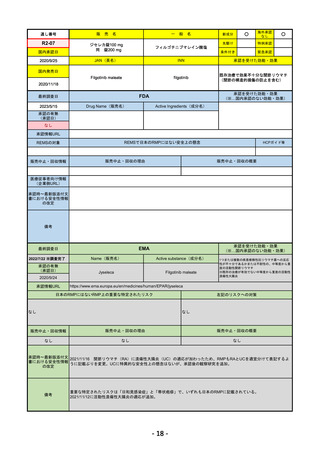
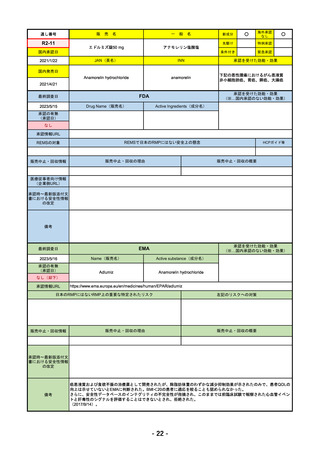
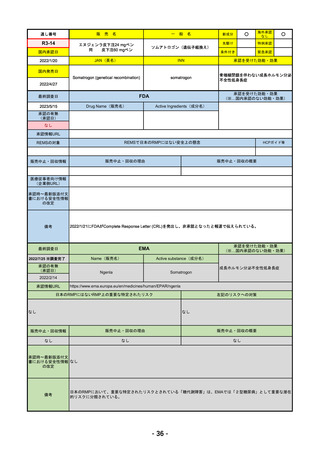
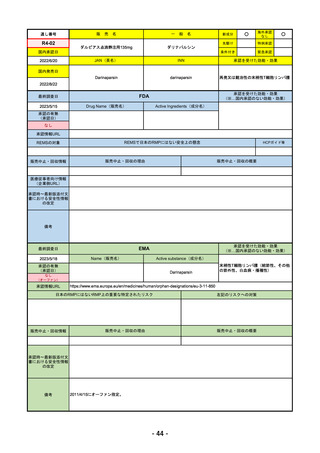
R4-09 ゾコーバ錠125mg
エンシトレルビルフマル酸塩
SARS-CoV-2による感染症
R4.11.22
なし
なし
51
R4-10 アリドネパッチ27.5mg 他1規格
ドネペジル
アルツハイマー型認知症における認知症症状の進行抑制
R4.12.23
なし
なし
52
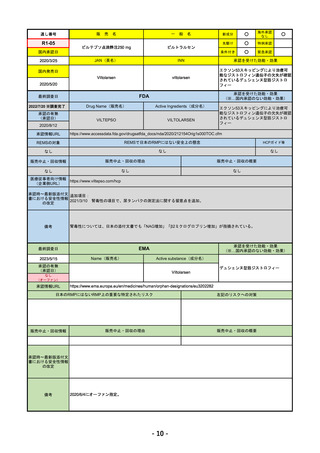
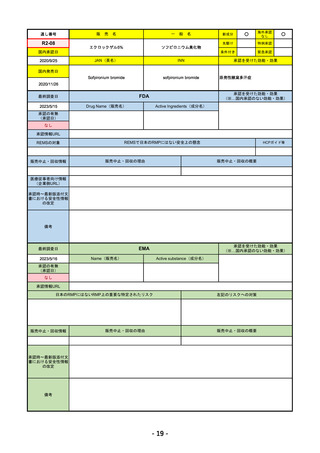
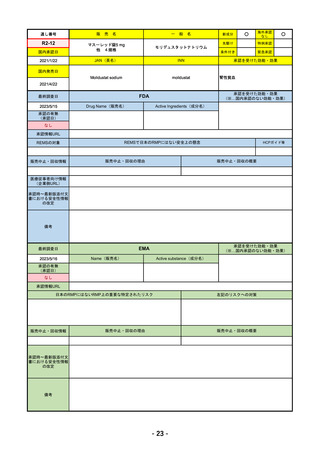
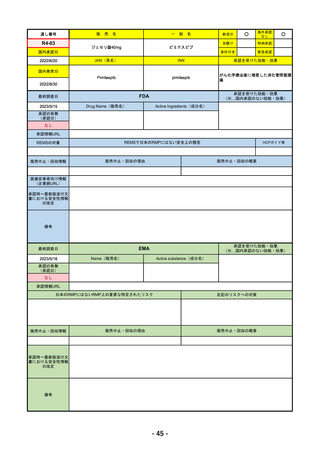
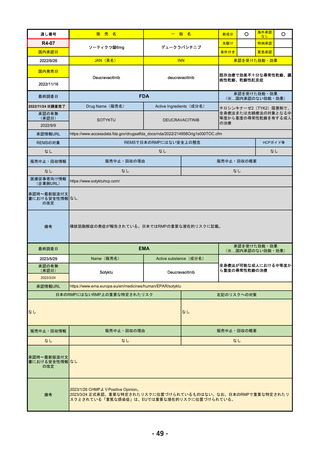
R4-11 イジュド点滴静注25mg 他1規格
トレメリムマブ(遺伝子組換え)
切除不能な進行・再発の非小細胞肺癌及び切除不能な肝細胞癌
R4.12.23
2022/11/10
2023/2/20
53
R4-12 リブタヨ点滴静注350mg
セミプリマブ(遺伝子組換え)
がん化学療法後に増悪した進行又は再発の子宮頸癌
R4.12.23
2022/9/28
2019/6/28
(条件付承認)
2022/7/1
(通常承認)
54
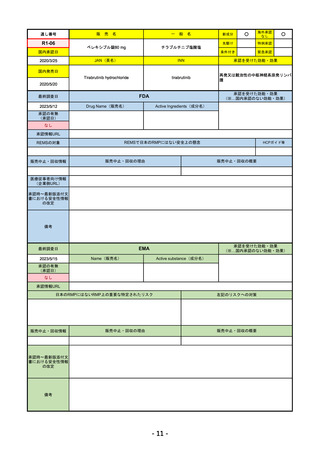
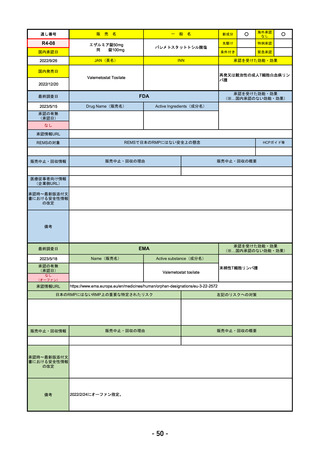
①オンボー点滴静注300mg
R4-13 ②
同 皮下注100mgオートインジェクター
③
同 皮下注100mgシリンジ
ミリキズマブ(遺伝子組換え)
①中等症から重症の潰瘍性大腸炎の寛解導入療法(既存治療で効果不十分な場
合に限る)
②③中等症から重症の潰瘍性大腸炎の維持療法(既存治療で効果不十分な場合
に限る)
R5.3.27
なし
なし
55
R4-14 ゴービック水性懸濁注シリンジ
百日せき菌の防御抗原
ジフテリアトキソイド
破傷風トキソイド
不活化ポリオウイルス1~3型
(Sabin株)
インフルエンザ菌b型オリゴ糖CRM197結合体
百日せき、ジフテリア、破傷風、急性灰白髄炎及びインフルエンザ菌b型によ
る感染症の予防
R5.3.27
なし
なし
56
※ 「販売名」「一般名」「承認を受けた効能・効果」「承認日」は、原則として調査の対象となった際の情報を記載している。
【個別医薬品の欧米での承認状況等の調査対象品目】
国内で令和2年度以降に販売が開始された新有効成分を含有する新医薬品のうち、以下のa~eのいずれかに該当するもの。
a 先駆的医薬品指定制度(先駆け審査指定制度)の対象品目
b 条件付き早期承認制度の対象品目
c 審査報告書の作成時点において、米国及び欧州で未承認であった品目
d 特例承認を受けた品目
e 緊急承認制度の対象品目
-5-
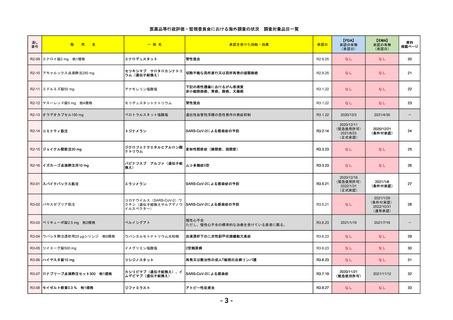
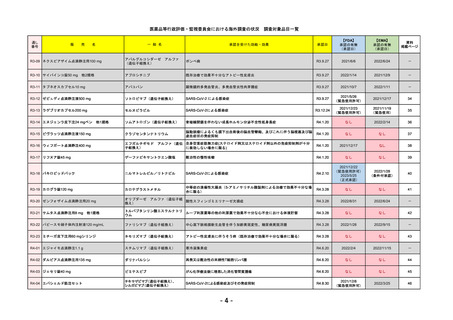
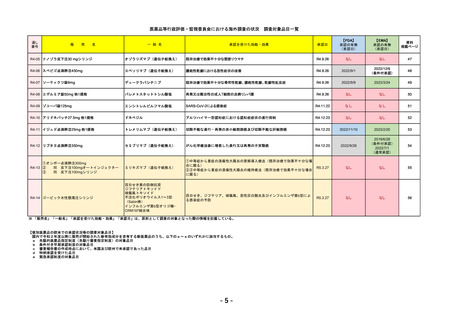
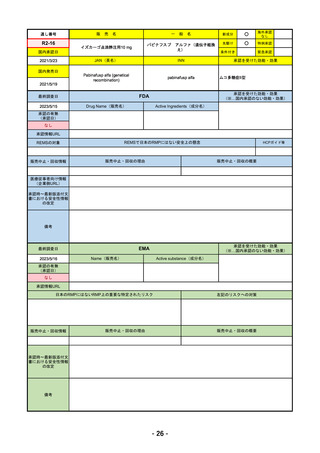
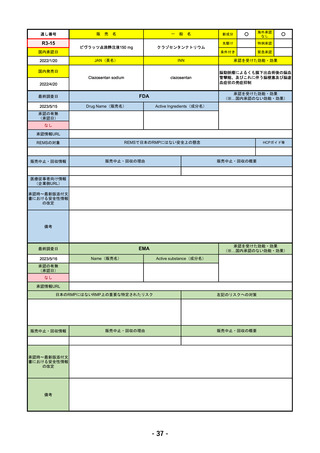
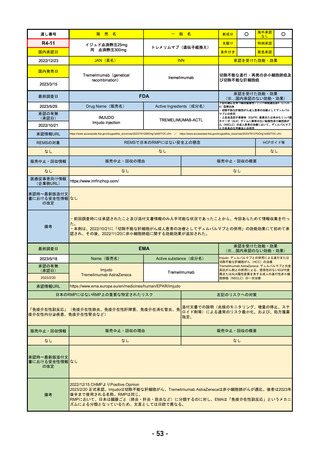
通し
番号
販
売
一 般 名
名
承認を受けた効能・効果
承認日
【FDA】
承認の有無
(承認日)
【EMA】
承認の有無
(承認日)
資料
掲載ページ
R4-05 ナノゾラ皮下注30 mgシリンジ
オゾラリズマブ(遺伝子組換え)
既存治療で効果不十分な関節リウマチ
R4.9.26
なし
なし
47
R4-06 スぺビゴ点滴静注450mg
スペソリマブ(遺伝子組換え)
膿疱性乾癬における急性症状の改善
R4.9.26
2022/9/1
2022/12/9
(条件付承認)
48
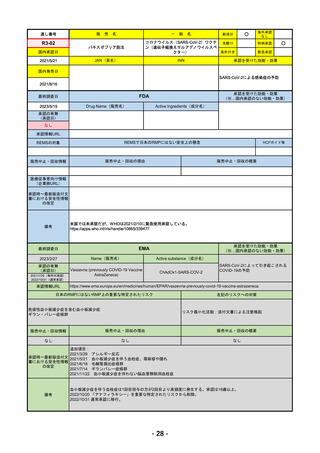
R4-07 ソーティクツ錠6mg
デュークラバシチニブ
既存治療で効果不十分な尋常性乾癬、膿疱性乾癬、乾癬性紅皮症
R4.9.26
2022/9/9
2023/3/24
49
R4-08 エザルミア錠50mg 他1規格
バレメトスタットトシル酸塩
再発又は難治性の成人T細胞白血病リンパ腫
R4.9.26
なし
なし
50
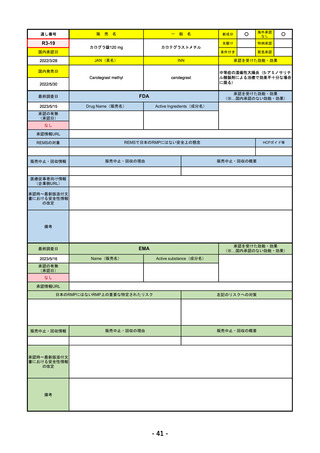
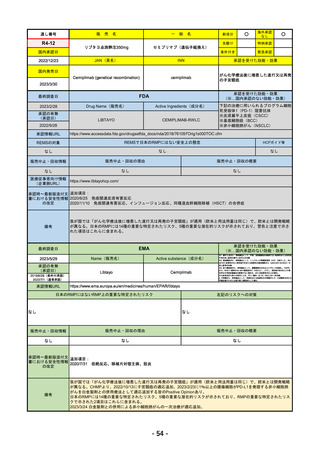
R4-09 ゾコーバ錠125mg
エンシトレルビルフマル酸塩
SARS-CoV-2による感染症
R4.11.22
なし
なし
51
R4-10 アリドネパッチ27.5mg 他1規格
ドネペジル
アルツハイマー型認知症における認知症症状の進行抑制
R4.12.23
なし
なし
52
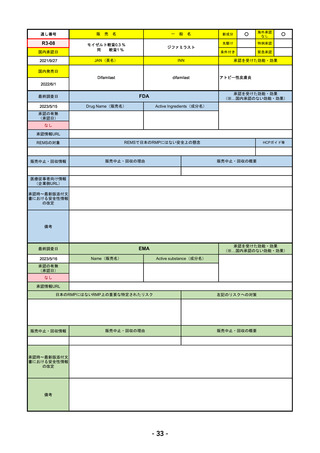
R4-11 イジュド点滴静注25mg 他1規格
トレメリムマブ(遺伝子組換え)
切除不能な進行・再発の非小細胞肺癌及び切除不能な肝細胞癌
R4.12.23
2022/11/10
2023/2/20
53
R4-12 リブタヨ点滴静注350mg
セミプリマブ(遺伝子組換え)
がん化学療法後に増悪した進行又は再発の子宮頸癌
R4.12.23
2022/9/28
2019/6/28
(条件付承認)
2022/7/1
(通常承認)
54
①オンボー点滴静注300mg
R4-13 ②
同 皮下注100mgオートインジェクター
③
同 皮下注100mgシリンジ
ミリキズマブ(遺伝子組換え)
①中等症から重症の潰瘍性大腸炎の寛解導入療法(既存治療で効果不十分な場
合に限る)
②③中等症から重症の潰瘍性大腸炎の維持療法(既存治療で効果不十分な場合
に限る)
R5.3.27
なし
なし
55
R4-14 ゴービック水性懸濁注シリンジ
百日せき菌の防御抗原
ジフテリアトキソイド
破傷風トキソイド
不活化ポリオウイルス1~3型
(Sabin株)
インフルエンザ菌b型オリゴ糖CRM197結合体
百日せき、ジフテリア、破傷風、急性灰白髄炎及びインフルエンザ菌b型によ
る感染症の予防
R5.3.27
なし
なし
56
※ 「販売名」「一般名」「承認を受けた効能・効果」「承認日」は、原則として調査の対象となった際の情報を記載している。
【個別医薬品の欧米での承認状況等の調査対象品目】
国内で令和2年度以降に販売が開始された新有効成分を含有する新医薬品のうち、以下のa~eのいずれかに該当するもの。
a 先駆的医薬品指定制度(先駆け審査指定制度)の対象品目
b 条件付き早期承認制度の対象品目
c 審査報告書の作成時点において、米国及び欧州で未承認であった品目
d 特例承認を受けた品目
e 緊急承認制度の対象品目
-5-