よむ、つかう、まなぶ。
【資料4】医薬品等行政評価・監視委員会における海外調査 (53 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33889.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第12回 6/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
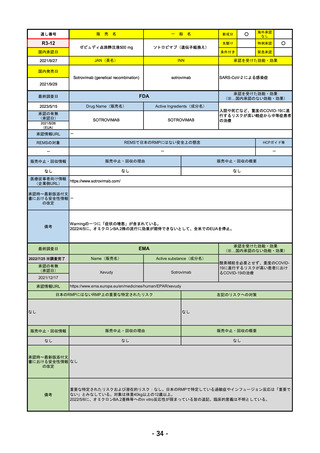
販
通し番号
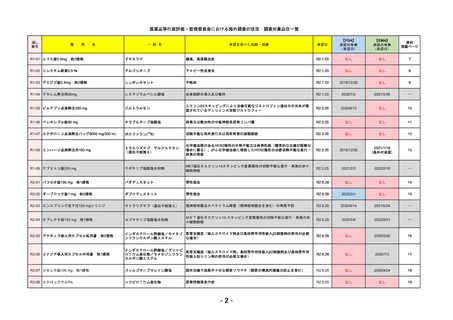
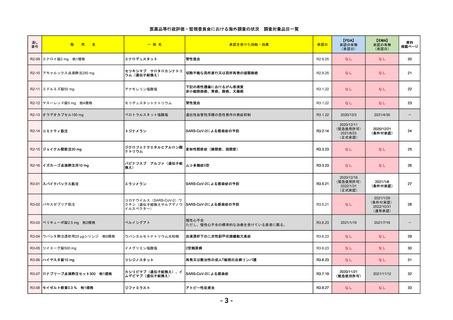
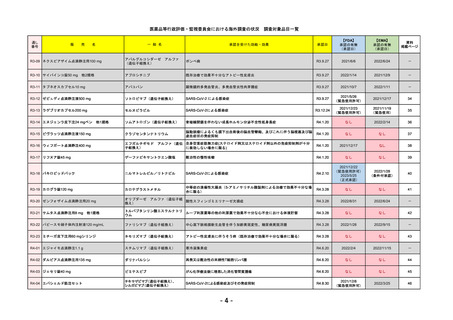
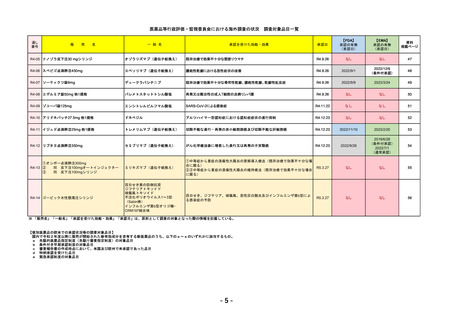
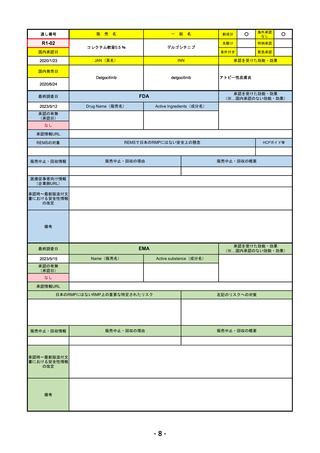
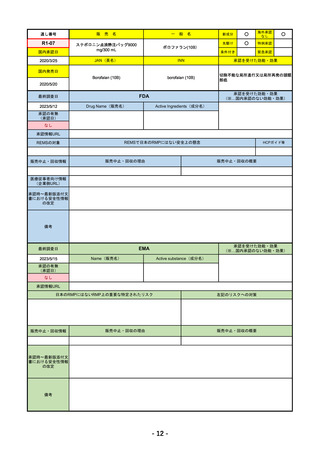
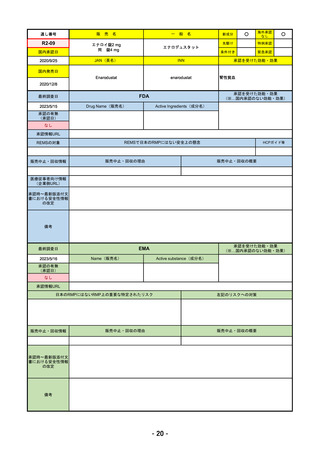
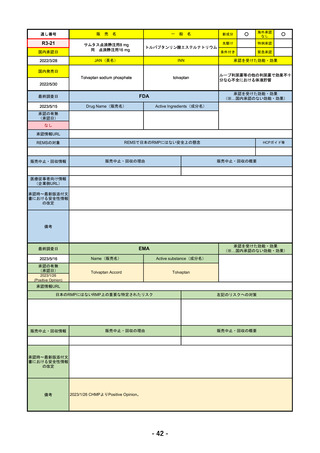
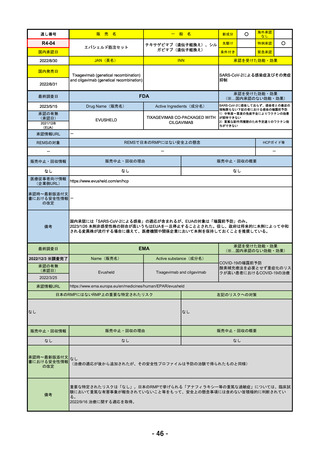
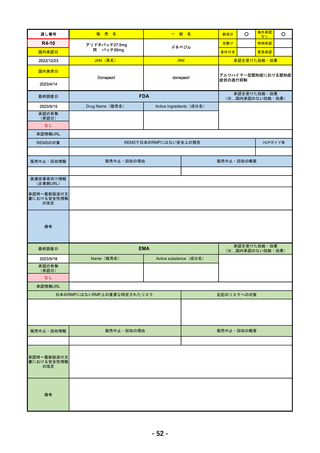
R4-11
国内承認日
2022/12/23
国内発売日
2023/3/15
売
名
一
名
承認の有無
(承認日)
2022/10/21
○
海外承認
なし
○
先駆け
0
特例承認
0
条件付き
0
緊急承認
0
トレメリムマブ(遺伝子組換え)
JAN(英名)
INN
承認を受けた効能・効果
Tremelimumab(genetical
recombination)
tremelimumab
切除不能な進行・再発の非小細胞肺癌及
び切除不能な肝細胞癌
承認を受けた効能・効果
(※…国内承認のない効能・効果)
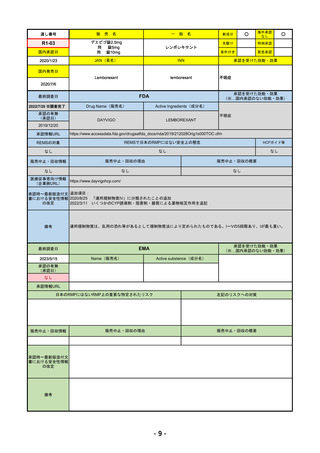
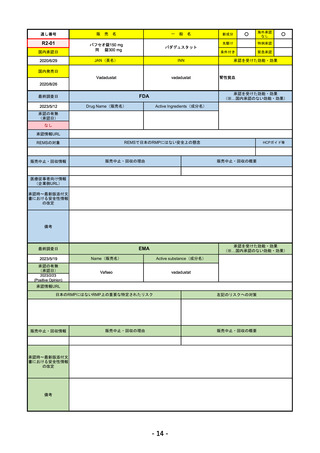
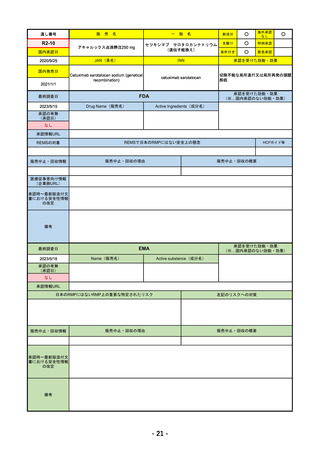
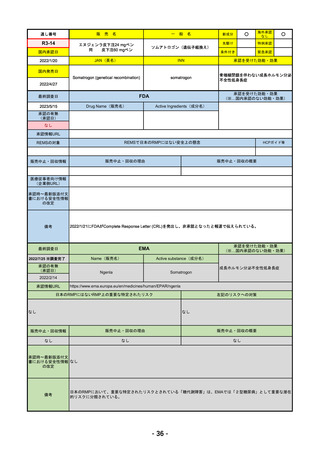
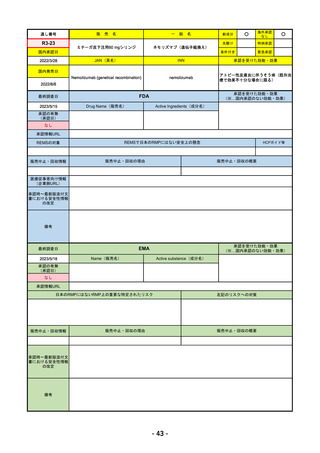
FDA
2023/5/29
新成分
イジュド点滴静注25mg
同 点滴静注300mg
最終調査日
承認情報URL
般
Drug Name(販売名)
Active Ingredients(成分名)
IMJUDO
Imjudo injection
TREMELIMUMAB-ACTL
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2022/761289Orig1s000TOC.cfm
/
下記の適応を持つ細胞傷害性Tリンパ球関連抗原4(CTLA4)阻害抗体
・切除不能な肝細胞がん成人患者の治療としてデュルバル
マブとの併用
・上皮成長因子受容体(EGFR)変異または未分化リンパ腫
キナーゼ(ALK)ゲノムに異常のない転移性非小細胞肺が
ん(NSCLC)の成人患者の治療において、デュルバルマブ
と白金系の化学療法との併用
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2023/761270Orig1s000TOC.cfm
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
なし
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
https://www.imfinzihcp.com/
(企業側URL)
承認時~最新版添付文
書における安全性情報 なし
の改定
・前回調査時には承認されたこと及び添付文書情報のみ入手可能な状況であったことから、今回あらためて情報収集を行っ
た。
・本剤は、2022/10/21に「切除不能な肝細胞がん成人患者の治療としてデュルバルマブとの併用」の効能効果にて初めて承
認され、その後、2022/11/20に非小細胞肺癌に関する効能効果が追加された。
備考
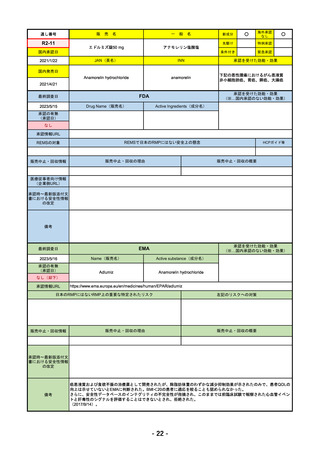
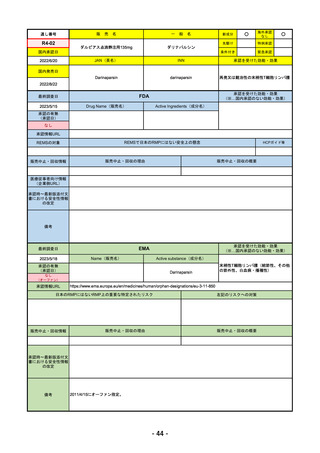
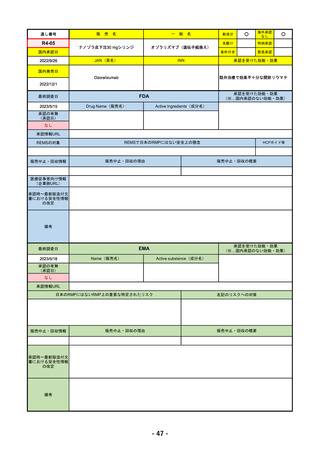
2023/5/18
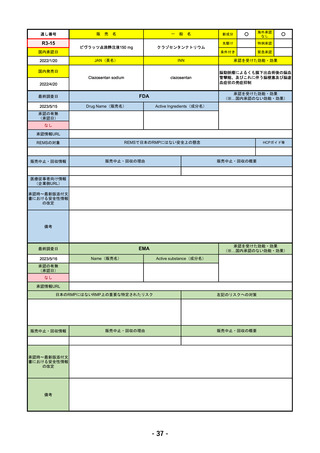
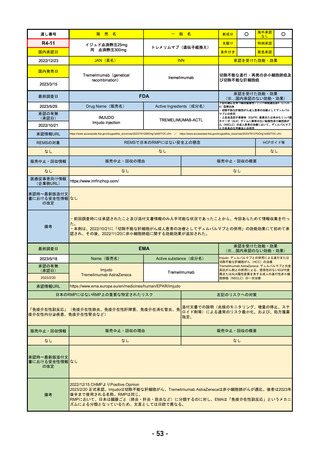
承認の有無
(承認日)
2023/2/20
承認情報URL
承認を受けた効能・効果
(※…国内承認のない効能・効果)
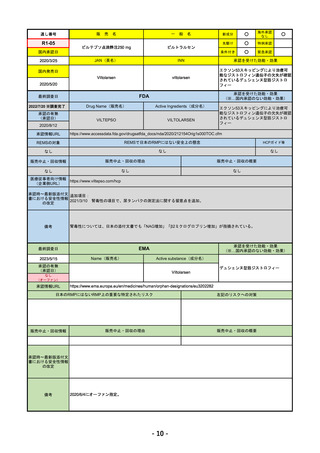
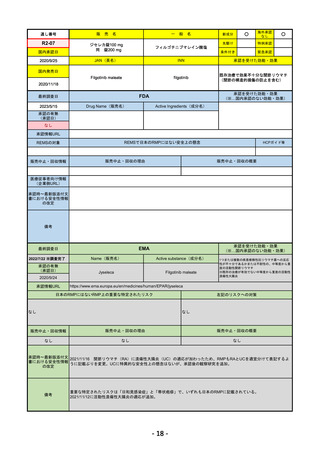
EMA
最終調査日
Name(販売名)
Active substance(成分名)
Imjudo
Tremelimumab AstraZeneca
Tremelimumab
Imjudo: デュルバルマブとの併用による進行または
切除不能な肝細胞がん(HCC)の治療
Tremelimumab AstraZeneca: デュルバルマブと白金
系抗がん剤との併用による、感受性のないEGFR変
異またはALK陽性変異を有する成人の進行性非小細
胞肺癌(NSCLC)の一次治療
https://www.ema.europa.eu/en/medicines/human/EPAR/imjudo
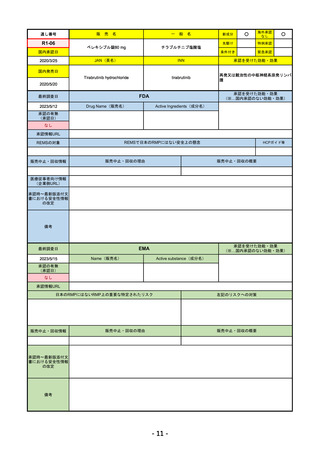
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
添付文書での説明(兆候のモニタリング、増量の停止、ステ
「免疫介在性副反応」(免疫介在性肺炎、免疫介在性肝障害、免疫介在消化管炎、免
ロイド剤等)による通常のリスク最小化、および、処方箋薬
疫介在性内分泌疾患、免疫介在性腎炎など)
指定。
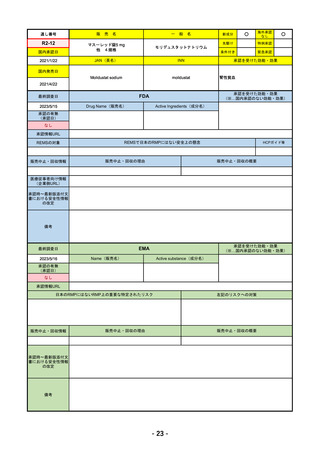
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付文
書における安全性情報 なし
の改定
備考
2022/12/15 CHMPよりPositive Opinion
2023/2/20 正式承認。Imjudoは切除不能な肝細胞がん、Tremelimumab AstraZenecaは非小細胞肺がんが適応。後者は2023年
後半まで使用される名称。RMPは同じ。
RMPにおいて、日本は臓器ごと(肺炎・肝炎・筋炎など)に分類するのに対し、EMAは「免疫介在性副反応」というメカニ
ズムによる分類となっているため、文言としては日欧で異なる。
- 53 -
通し番号
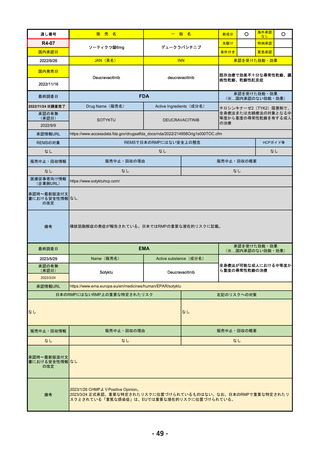
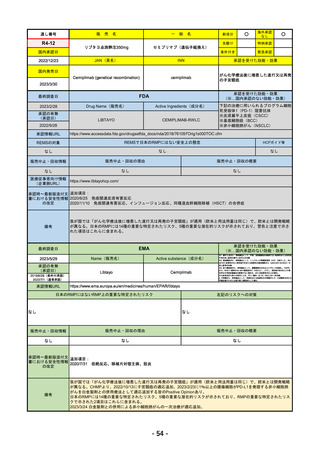
R4-11
国内承認日
2022/12/23
国内発売日
2023/3/15
売
名
一
名
承認の有無
(承認日)
2022/10/21
○
海外承認
なし
○
先駆け
0
特例承認
0
条件付き
0
緊急承認
0
トレメリムマブ(遺伝子組換え)
JAN(英名)
INN
承認を受けた効能・効果
Tremelimumab(genetical
recombination)
tremelimumab
切除不能な進行・再発の非小細胞肺癌及
び切除不能な肝細胞癌
承認を受けた効能・効果
(※…国内承認のない効能・効果)
FDA
2023/5/29
新成分
イジュド点滴静注25mg
同 点滴静注300mg
最終調査日
承認情報URL
般
Drug Name(販売名)
Active Ingredients(成分名)
IMJUDO
Imjudo injection
TREMELIMUMAB-ACTL
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2022/761289Orig1s000TOC.cfm
/
下記の適応を持つ細胞傷害性Tリンパ球関連抗原4(CTLA4)阻害抗体
・切除不能な肝細胞がん成人患者の治療としてデュルバル
マブとの併用
・上皮成長因子受容体(EGFR)変異または未分化リンパ腫
キナーゼ(ALK)ゲノムに異常のない転移性非小細胞肺が
ん(NSCLC)の成人患者の治療において、デュルバルマブ
と白金系の化学療法との併用
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2023/761270Orig1s000TOC.cfm
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
なし
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
https://www.imfinzihcp.com/
(企業側URL)
承認時~最新版添付文
書における安全性情報 なし
の改定
・前回調査時には承認されたこと及び添付文書情報のみ入手可能な状況であったことから、今回あらためて情報収集を行っ
た。
・本剤は、2022/10/21に「切除不能な肝細胞がん成人患者の治療としてデュルバルマブとの併用」の効能効果にて初めて承
認され、その後、2022/11/20に非小細胞肺癌に関する効能効果が追加された。
備考
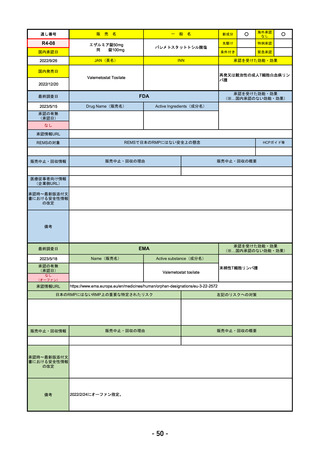
2023/5/18
承認の有無
(承認日)
2023/2/20
承認情報URL
承認を受けた効能・効果
(※…国内承認のない効能・効果)
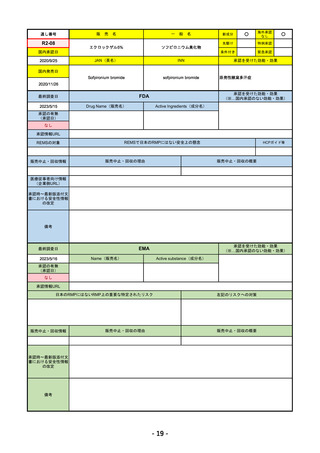
EMA
最終調査日
Name(販売名)
Active substance(成分名)
Imjudo
Tremelimumab AstraZeneca
Tremelimumab
Imjudo: デュルバルマブとの併用による進行または
切除不能な肝細胞がん(HCC)の治療
Tremelimumab AstraZeneca: デュルバルマブと白金
系抗がん剤との併用による、感受性のないEGFR変
異またはALK陽性変異を有する成人の進行性非小細
胞肺癌(NSCLC)の一次治療
https://www.ema.europa.eu/en/medicines/human/EPAR/imjudo
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
添付文書での説明(兆候のモニタリング、増量の停止、ステ
「免疫介在性副反応」(免疫介在性肺炎、免疫介在性肝障害、免疫介在消化管炎、免
ロイド剤等)による通常のリスク最小化、および、処方箋薬
疫介在性内分泌疾患、免疫介在性腎炎など)
指定。
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付文
書における安全性情報 なし
の改定
備考
2022/12/15 CHMPよりPositive Opinion
2023/2/20 正式承認。Imjudoは切除不能な肝細胞がん、Tremelimumab AstraZenecaは非小細胞肺がんが適応。後者は2023年
後半まで使用される名称。RMPは同じ。
RMPにおいて、日本は臓器ごと(肺炎・肝炎・筋炎など)に分類するのに対し、EMAは「免疫介在性副反応」というメカニ
ズムによる分類となっているため、文言としては日欧で異なる。
- 53 -