よむ、つかう、まなぶ。
【資料4】医薬品等行政評価・監視委員会における海外調査 (54 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33889.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第12回 6/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
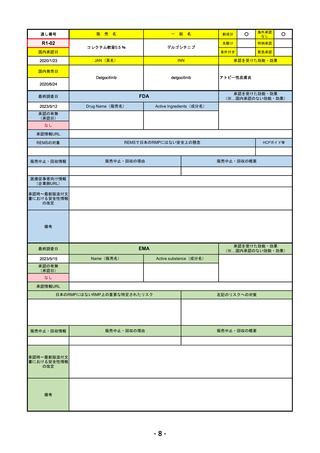
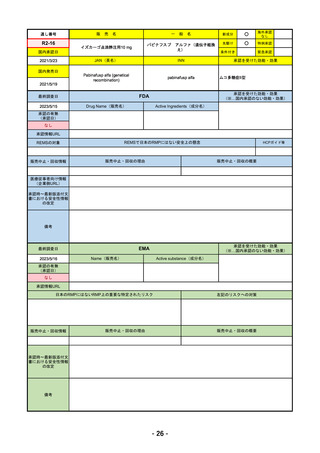
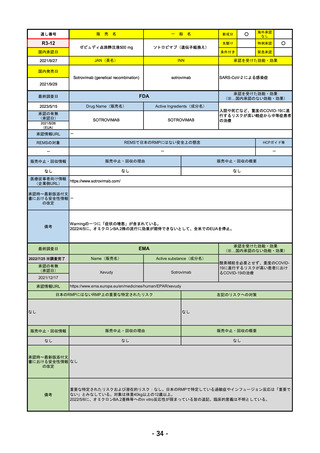
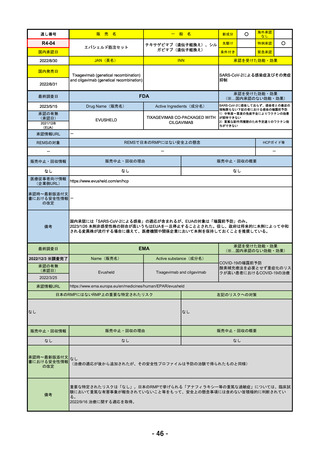
通し番号
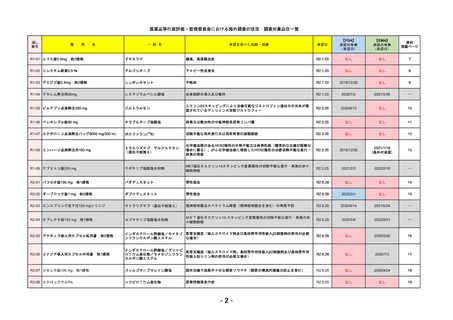
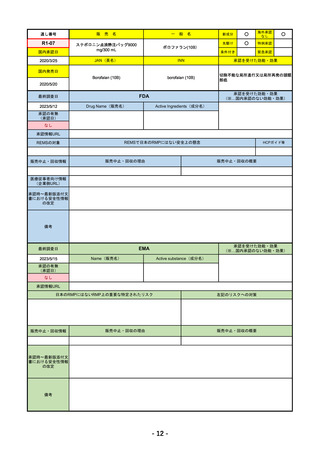
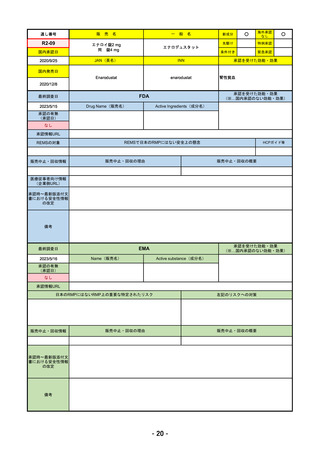
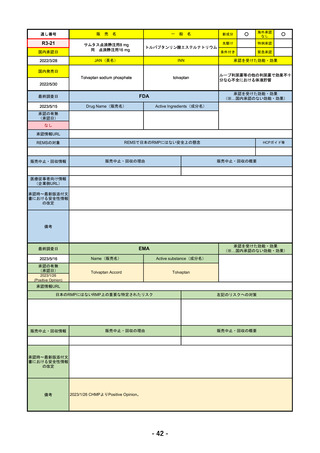
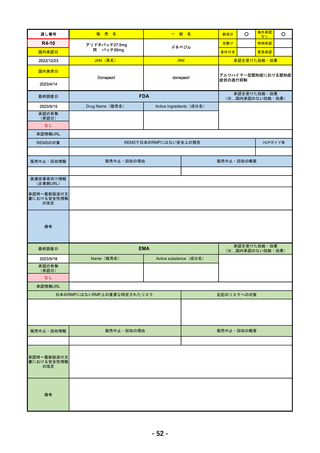
R4-12
販
売
名
一
リブタヨ点滴静注350mg
般
海外承認
なし
○
先駆け
0
特例承認
0
条件付き
0
緊急承認
0
JAN(英名)
INN
承認を受けた効能・効果
Cemiplimab (genetical recombination)
cemiplimab
がん化学療法後に増悪した進行又は再発
の子宮頸癌
国内発売日
2023/3/30
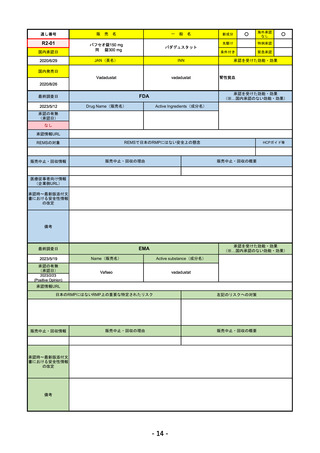
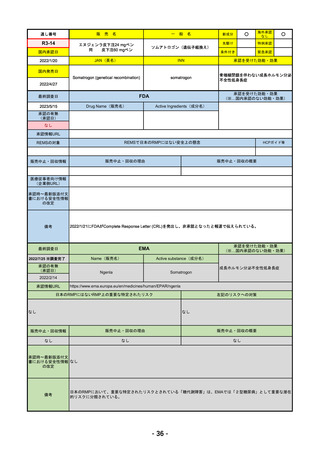
承認を受けた効能・効果
(※…国内承認のない効能・効果)
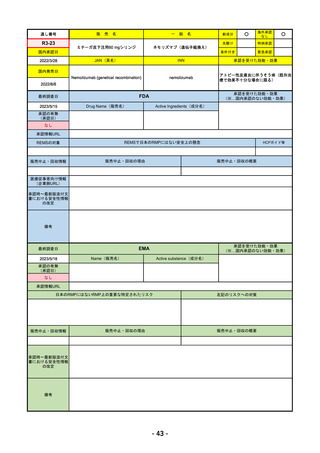
FDA
最終調査日
2023/2/28
Drug Name(販売名)
Active Ingredients(成分名)
承認の有無
(承認日)
LIBTAYO
CEMIPLIMAB-RWLC
2022/9/28
承認情報URL
○
セミプリマブ(遺伝子組換え)
国内承認日
2022/12/23
新成分
名
下記の治療に用いられるプログラム細胞
死受容体1(PD-1)阻害抗体
※皮膚扁平上皮癌(CSCC)
※基底細胞癌(BCC)
※非小細胞肺がん(NSCLC)
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2018/761097Orig1s000TOC.cfm
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
なし
なし
なし
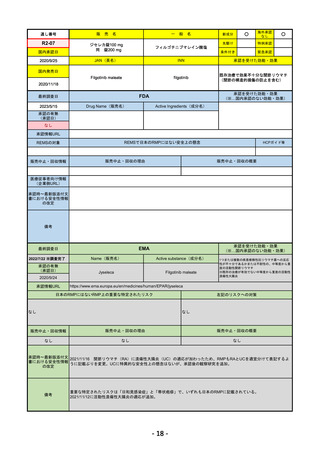
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
https://www.libtayohcp.com/
(企業側URL)
承認時~最新版添付文 追加項目:
書における安全性情報 2020/6/25 免疫関連皮膚有害反応
の改定
2020/11/10 免疫関連有害反応、インフュージョン反応、同種造血幹細胞移植(HSCT)の合併症
我が国では「がん化学療法後に増悪した進行又は再発の子宮頸癌」が適用(欧米と用法用量は同じ)で、欧米とは開発戦略
が異なる。日本のRMPには14種の重要な特定されたリスク、5種の重要な潜在的リスクが示されており、警告と注意で示さ
れた項目はこれらに含まれる。
備考
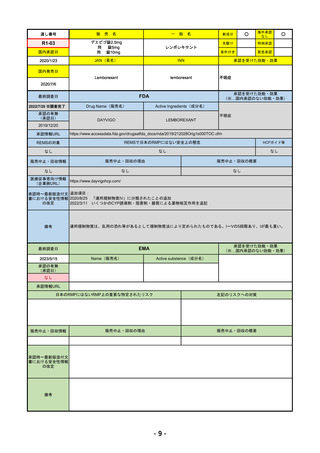
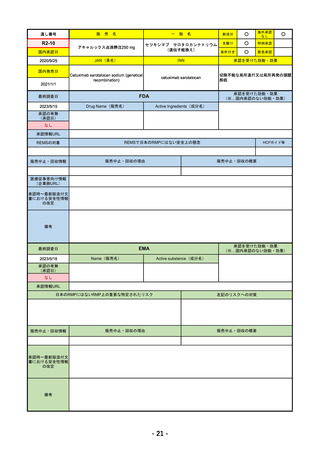
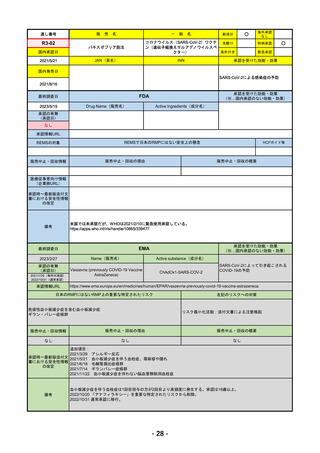
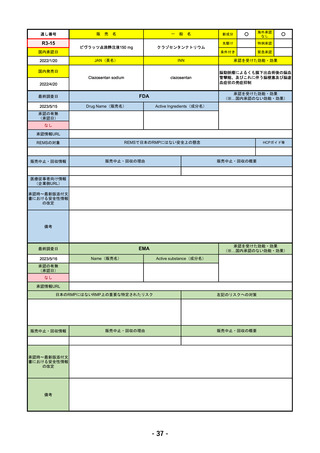
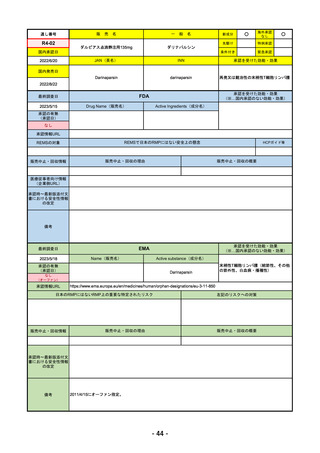
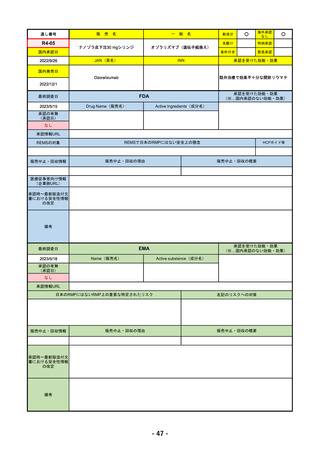
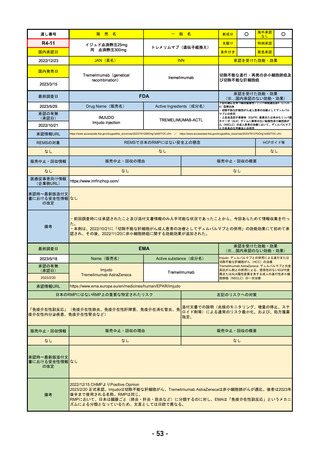
承認を受けた効能・効果
(※…国内承認のない効能・効果)
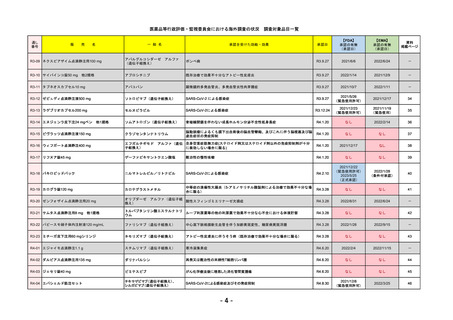
EMA
最終調査日
2023/5/29
Name(販売名)
Active substance(成分名)
承認の有無
(承認日)
Libtayo
Cemiplimab
2019/6/28(条件付承認)
2022/7/1(通常承認)
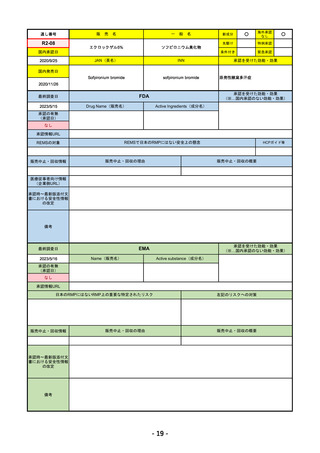
承認情報URL
※1. 扁平上皮がん:単剤療法として、手術、放射線療法の候補でない転移性または局所進
行性の成人患者の扁平上皮がんの治療
※2. 基底細胞がん:単剤療法として、ヘッジホッグ経路阻害剤(HHI)で進行した、また
はHHIに忍容性のない局所進行性または転移性の基底細胞がん(laBCCまたはmBCC)の
成人患者の治療
※3. 非小細胞肺がん:単剤療法として、腫瘍細胞の50%以上にPD-L1を発現し、EGFR、
ALK、ROS1に異常のない非小細胞肺がん(NSCLC)。ただし、局所進行性NSCLCで根
治的な化学放射線療法の候補でない場合か、または転移性NSCLCの場合。
※白金系抗がん剤との併用による、PD-L1陽性(≧1%)NSCLCの一次治療。
4. 子宮頸がん:単剤療法として、再発性または転移性の子宮頸がんで、白金製剤を含む化
学療法施行中または施行後に病勢進行した場合。
https://www.ema.europa.eu/en/medicines/human/EPAR/libtayo
日本のRMPにはないRMP上の重要な特定されたリスク
なし
左記のリスクへの対策
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付文 追加項目:
書における安全性情報
2020/7/31 拒絶反応、移植片対宿主病、筋炎
の改定
備考
我が国では「がん化学療法後に増悪した進行又は再発の子宮頸癌」が適用(欧米と用法用量は同じ)で、欧米とは開発戦略
が異なる。CHMPより、2022/10/13に子宮頸癌の適応追加、2023/2/23に1%以上の腫瘍細胞がPD-L1を発現する非小細胞肺
がんを白金製剤との併用療法として適応追加する旨のPositive Opinionあり。
日本のRMPには14種の重要な特定されたリスク、5種の重要な潜在的リスクが示されており、RMPの重要な特定されたリス
クで示された2項目はこれらに含まれる。
2023/3/24 白金製剤との併用による非小細胞肺がんの一次治療が適応追加。
- 54 -
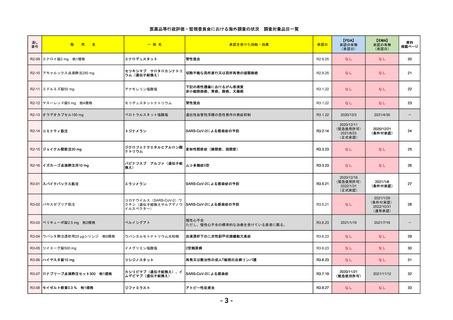
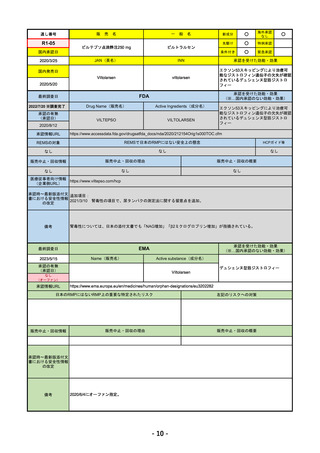
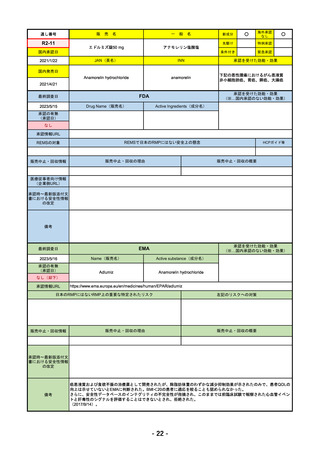
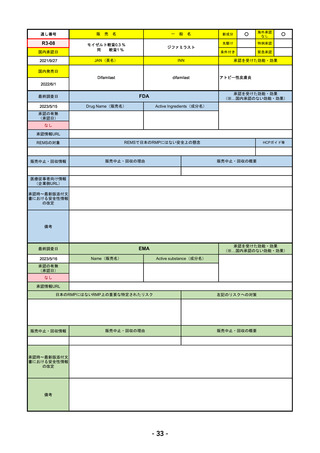
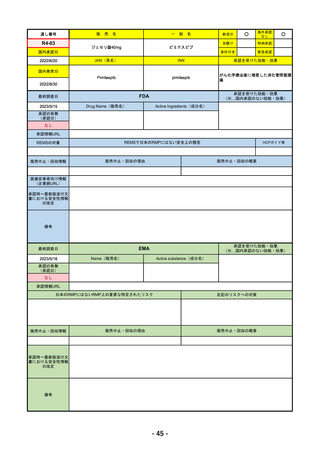
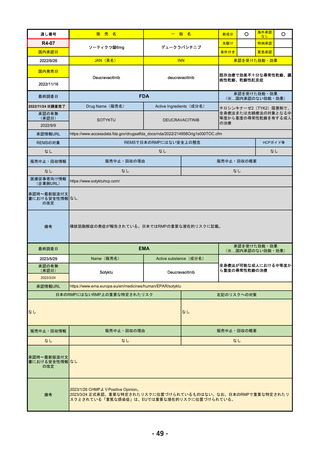
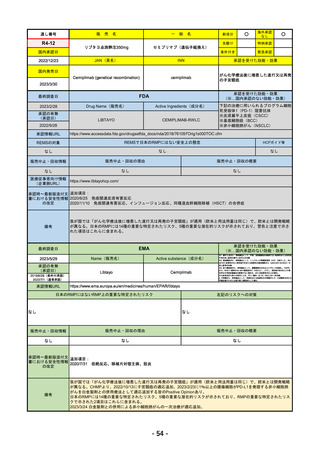
R4-12
販
売
名
一
リブタヨ点滴静注350mg
般
海外承認
なし
○
先駆け
0
特例承認
0
条件付き
0
緊急承認
0
JAN(英名)
INN
承認を受けた効能・効果
Cemiplimab (genetical recombination)
cemiplimab
がん化学療法後に増悪した進行又は再発
の子宮頸癌
国内発売日
2023/3/30
承認を受けた効能・効果
(※…国内承認のない効能・効果)
FDA
最終調査日
2023/2/28
Drug Name(販売名)
Active Ingredients(成分名)
承認の有無
(承認日)
LIBTAYO
CEMIPLIMAB-RWLC
2022/9/28
承認情報URL
○
セミプリマブ(遺伝子組換え)
国内承認日
2022/12/23
新成分
名
下記の治療に用いられるプログラム細胞
死受容体1(PD-1)阻害抗体
※皮膚扁平上皮癌(CSCC)
※基底細胞癌(BCC)
※非小細胞肺がん(NSCLC)
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2018/761097Orig1s000TOC.cfm
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
なし
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
https://www.libtayohcp.com/
(企業側URL)
承認時~最新版添付文 追加項目:
書における安全性情報 2020/6/25 免疫関連皮膚有害反応
の改定
2020/11/10 免疫関連有害反応、インフュージョン反応、同種造血幹細胞移植(HSCT)の合併症
我が国では「がん化学療法後に増悪した進行又は再発の子宮頸癌」が適用(欧米と用法用量は同じ)で、欧米とは開発戦略
が異なる。日本のRMPには14種の重要な特定されたリスク、5種の重要な潜在的リスクが示されており、警告と注意で示さ
れた項目はこれらに含まれる。
備考
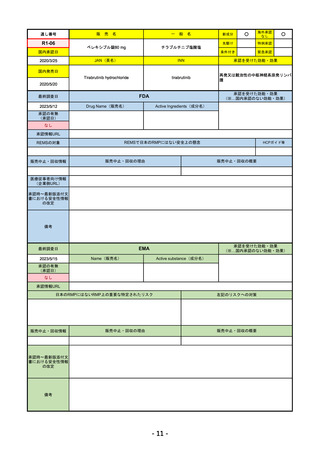
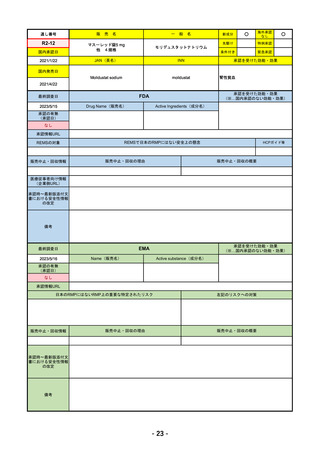
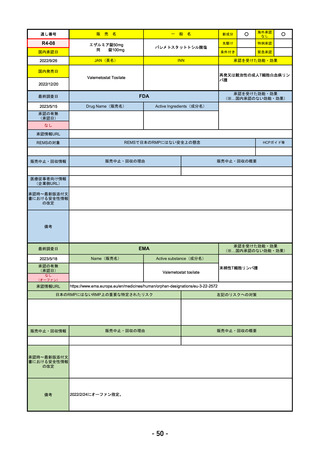
承認を受けた効能・効果
(※…国内承認のない効能・効果)
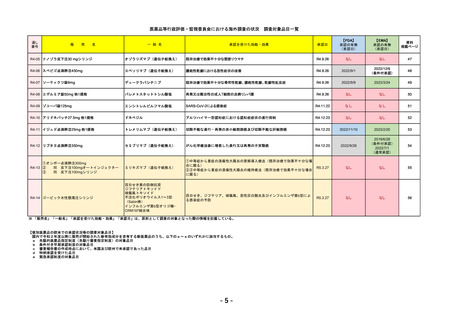
EMA
最終調査日
2023/5/29
Name(販売名)
Active substance(成分名)
承認の有無
(承認日)
Libtayo
Cemiplimab
2019/6/28(条件付承認)
2022/7/1(通常承認)
承認情報URL
※1. 扁平上皮がん:単剤療法として、手術、放射線療法の候補でない転移性または局所進
行性の成人患者の扁平上皮がんの治療
※2. 基底細胞がん:単剤療法として、ヘッジホッグ経路阻害剤(HHI)で進行した、また
はHHIに忍容性のない局所進行性または転移性の基底細胞がん(laBCCまたはmBCC)の
成人患者の治療
※3. 非小細胞肺がん:単剤療法として、腫瘍細胞の50%以上にPD-L1を発現し、EGFR、
ALK、ROS1に異常のない非小細胞肺がん(NSCLC)。ただし、局所進行性NSCLCで根
治的な化学放射線療法の候補でない場合か、または転移性NSCLCの場合。
※白金系抗がん剤との併用による、PD-L1陽性(≧1%)NSCLCの一次治療。
4. 子宮頸がん:単剤療法として、再発性または転移性の子宮頸がんで、白金製剤を含む化
学療法施行中または施行後に病勢進行した場合。
https://www.ema.europa.eu/en/medicines/human/EPAR/libtayo
日本のRMPにはないRMP上の重要な特定されたリスク
なし
左記のリスクへの対策
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付文 追加項目:
書における安全性情報
2020/7/31 拒絶反応、移植片対宿主病、筋炎
の改定
備考
我が国では「がん化学療法後に増悪した進行又は再発の子宮頸癌」が適用(欧米と用法用量は同じ)で、欧米とは開発戦略
が異なる。CHMPより、2022/10/13に子宮頸癌の適応追加、2023/2/23に1%以上の腫瘍細胞がPD-L1を発現する非小細胞肺
がんを白金製剤との併用療法として適応追加する旨のPositive Opinionあり。
日本のRMPには14種の重要な特定されたリスク、5種の重要な潜在的リスクが示されており、RMPの重要な特定されたリス
クで示された2項目はこれらに含まれる。
2023/3/24 白金製剤との併用による非小細胞肺がんの一次治療が適応追加。
- 54 -