資料2-3 MID-NET・NDBの行政利活用の調査実施状況について[25.3MB] (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33888.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第1回 6/29)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
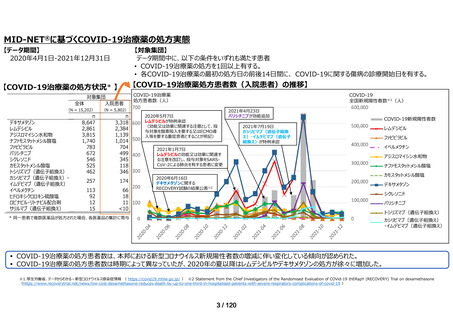
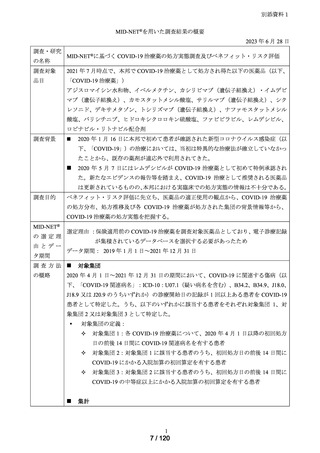
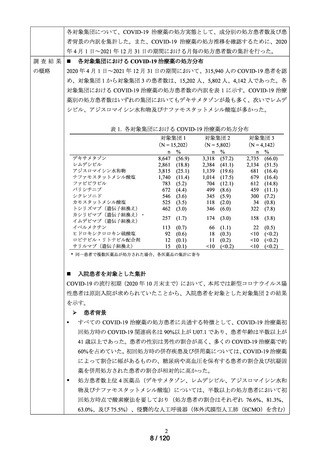
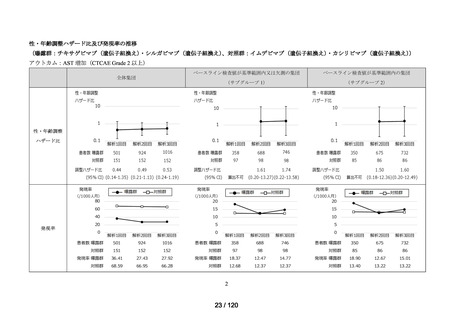
MID-NET®を用いた調査結果の概要
(2023 年 6 月時点報告)
2023 年 6 月 28 日
調査・研究の名
MID-NET®を用いたチキサゲビマブ(遺伝子組換え)
・シルガビマブ(遺伝子組換え)
称
による臨床検査値異常のリスク評価(シグナル検出)①
調査対象品目
チキサゲビマブ(遺伝子組換え)
・シルガビマブ(遺伝子組換え)
(以下、
「エバシェ
ルド」
)
調査目的
エバシェルド処方後の臨床検査値異常の発現頻度をイムデビマブ(遺伝子組換え)
・
カシリビマブ(遺伝子組換え)*1(以下、
「ロナプリーブ」)処方後の臨床検査値異常
の発現頻度と比較する。
*1 本調査で対象とする臨床検査値異常に関するロナプリーブのリスクは明らかではないものの、
2023 年 6 月 15 日時点のロナプリーブの注意事項等情報において本調査で対象とする臨床検査
値異常に関連する情報は記載されていない。
データソース
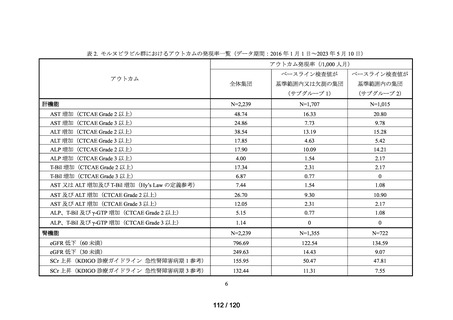
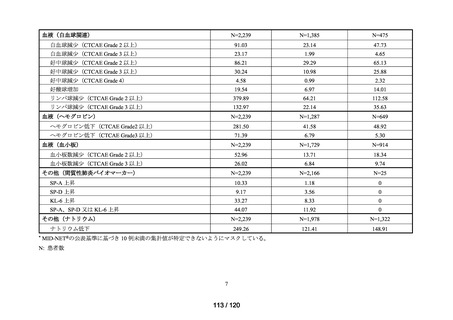
MID-NET®
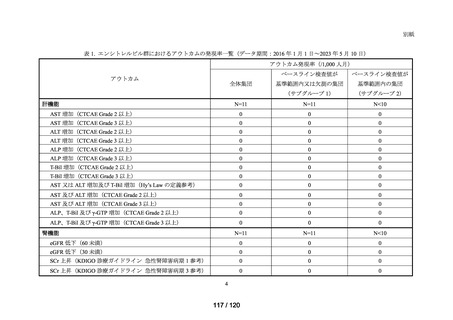
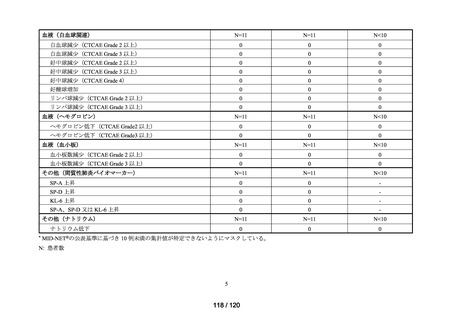
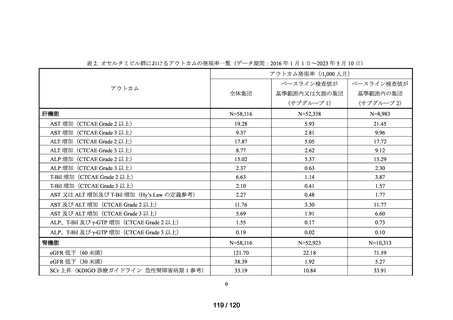
(データ期間:2016 年 1 月 1 日~2023 年 5 月 10 日)
調査方法の概略
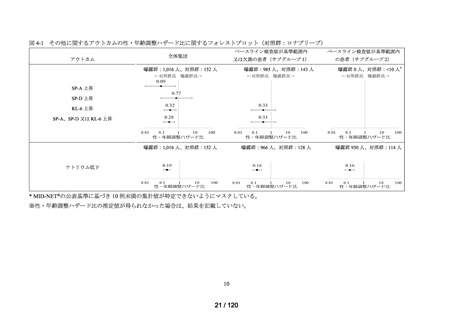
調査対象集団
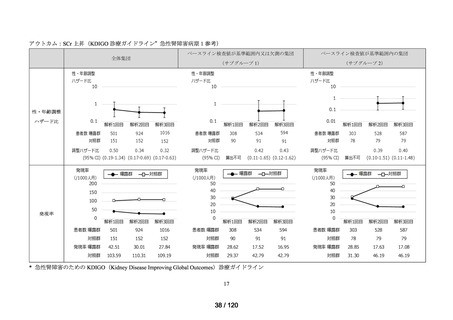
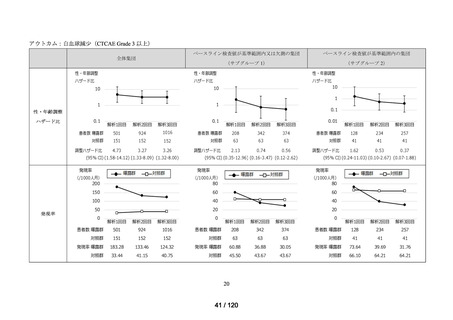
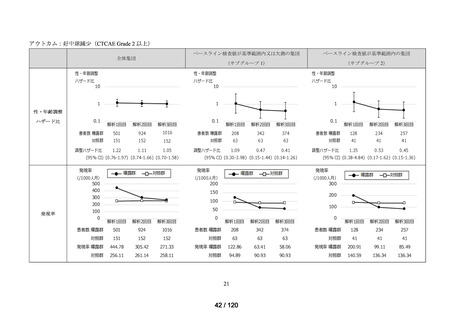
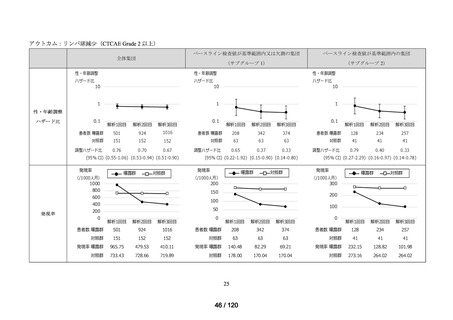
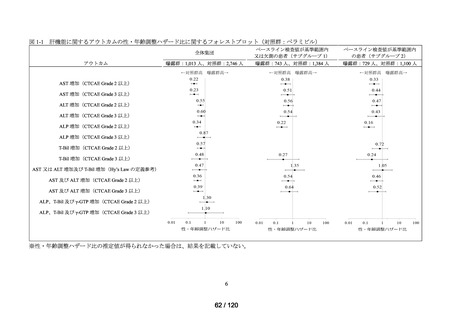
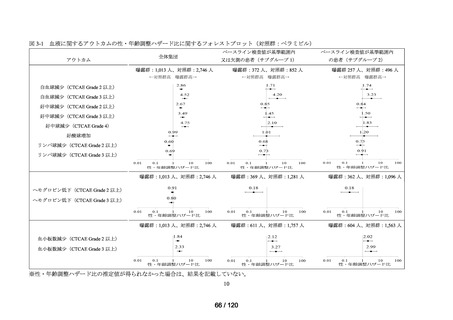
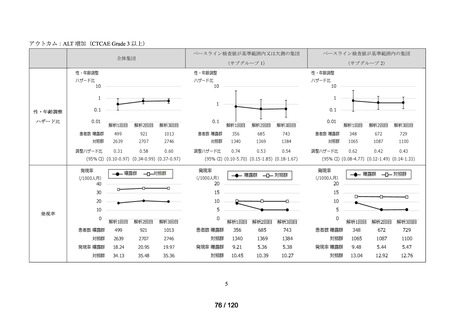
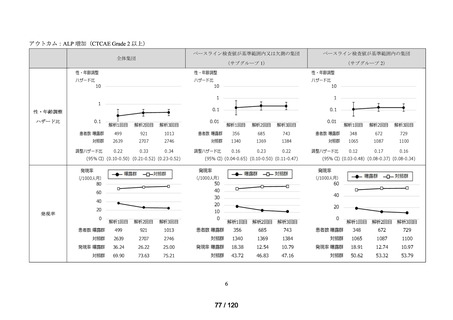
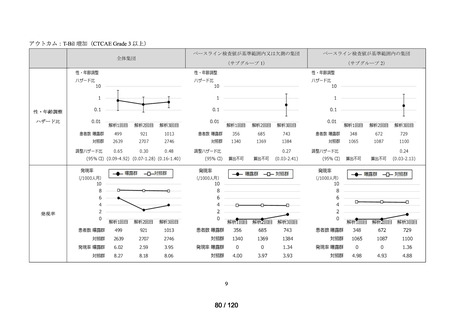
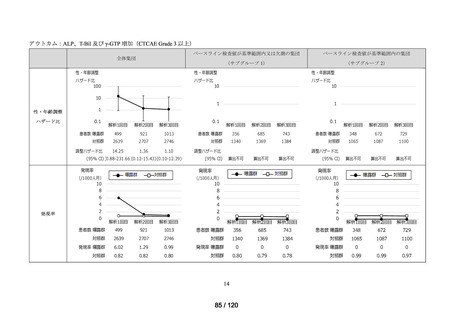
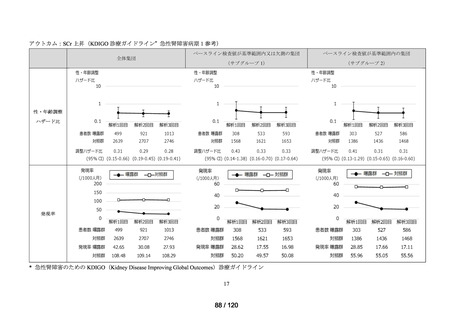
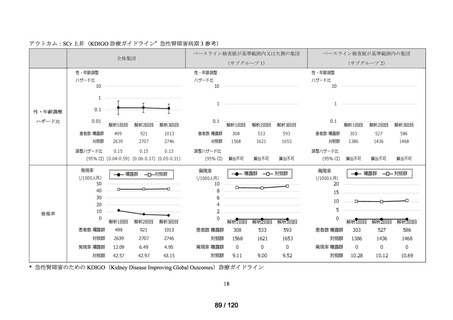
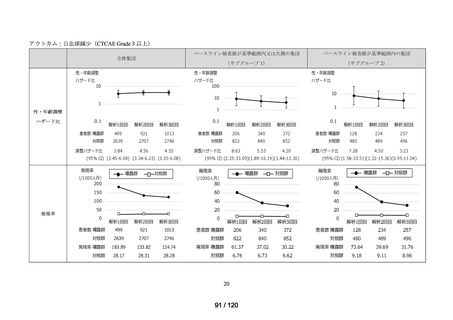
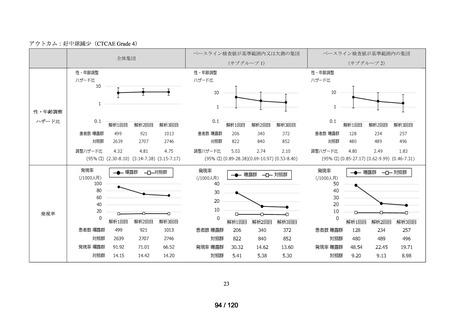
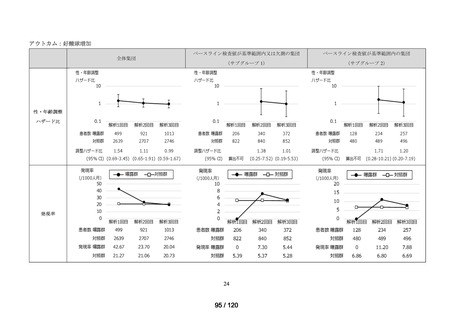
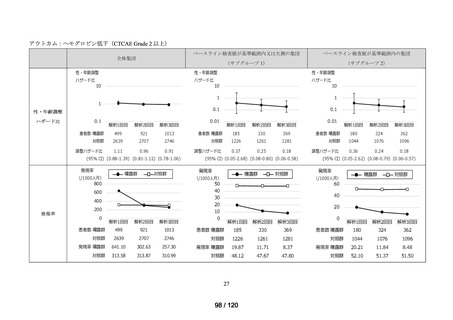
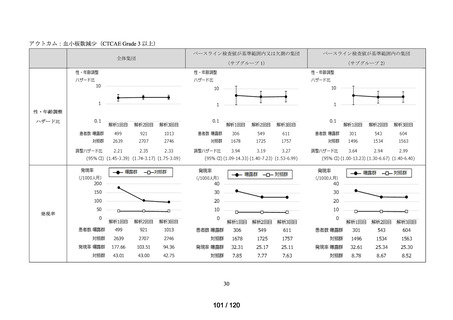
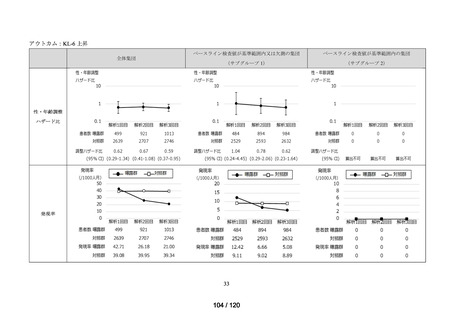
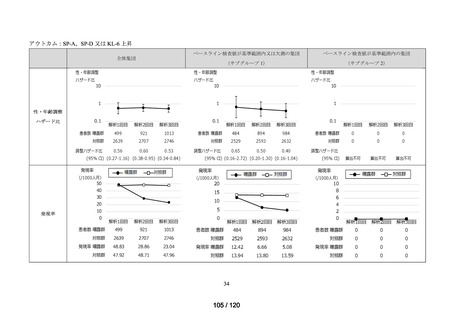
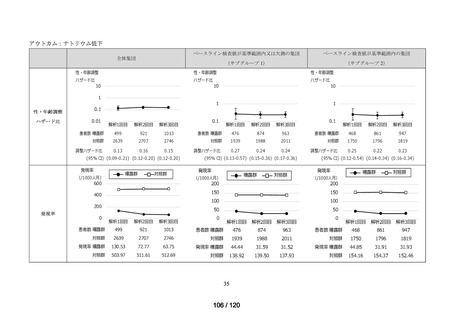
<全体集団>
データ期間中に曝露医薬品(エバシェルド)又は対照医薬品(ロナプリーブ)が新規
処方*2 された患者(ただし、初回処方日にエバシェルド及びロナプリーブの両方が処
方された患者は除く)を全体集団とした*3。初回処方日に処方された医薬品の種類に
応じて、曝露群(エバシェルド群)と対照群(ロナプリーブ群)に分類した。
*2 エバシェルド又はロナプリーブの初回処方日前の 90 日間にエバシェルド又はロナプリーブの
処方記録がない場合に新規処方とした。
*3 ベースライン検査値に関する条件がないため、ベースライン検査値においてアウトカムに該当
する臨床検査値異常が既に認められている患者も含まれる。
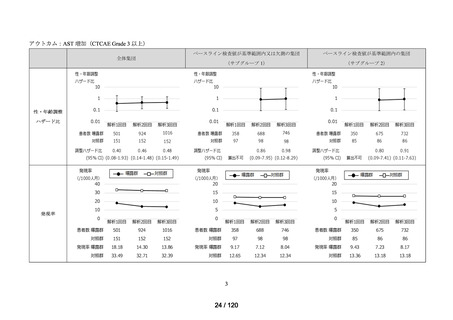
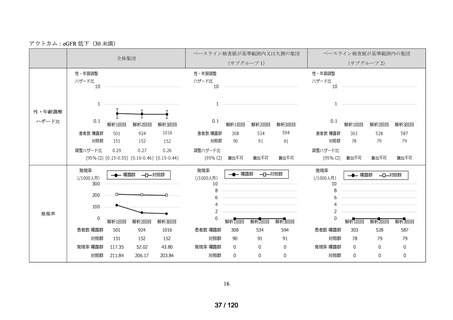
<サブグループ 1>
全体集団のうち、アウトカムに関連するベースライン検査値が基準範囲又は欠測の
患者をサブグループ 1 とした。
<サブグループ 2>
全体集団のうち、アウトカムに関連するベースライン検査値が基準範囲内の患者を
サブグループ 2 とした。
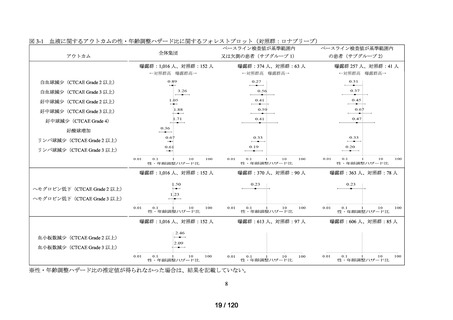
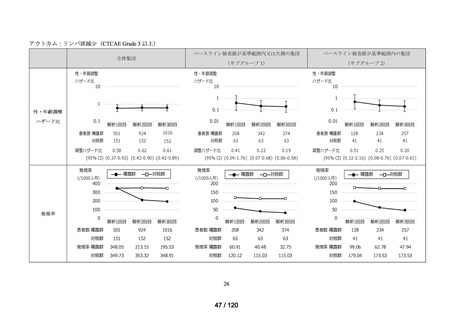
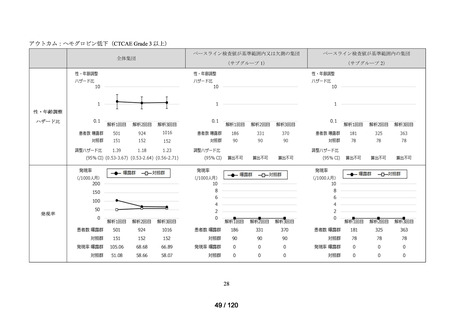
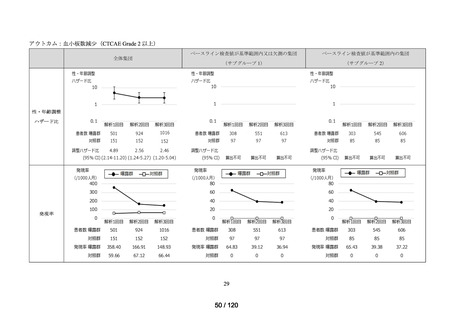
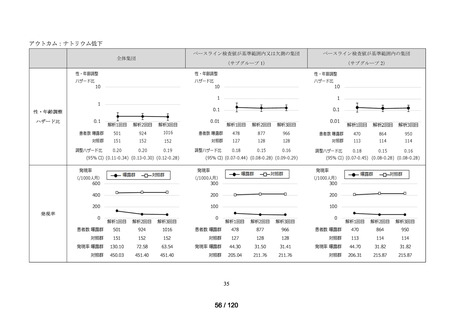
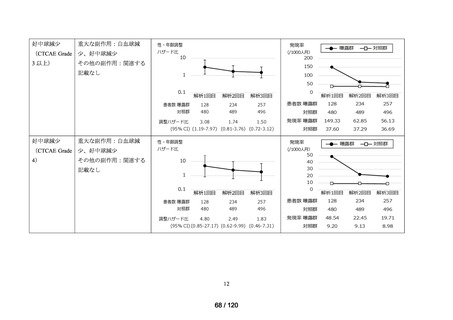
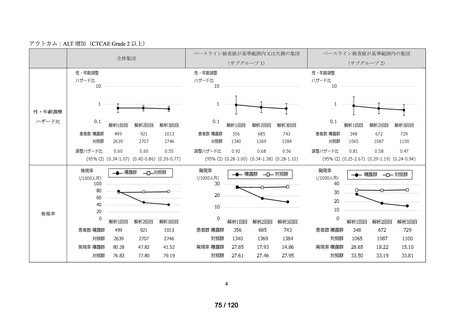
アウトカム
肝機能、腎機能、血液及びその他の 4 系統に分類した各種臨床検査値異常
1
12 / 120