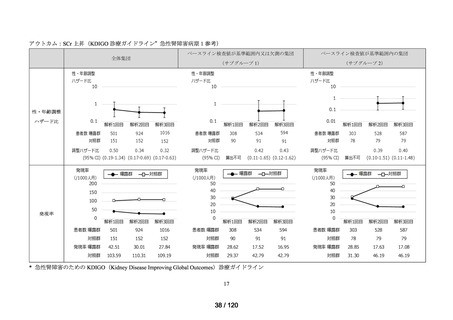
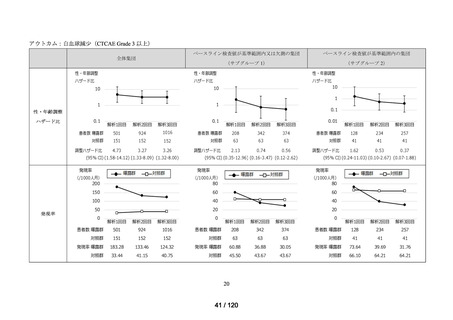
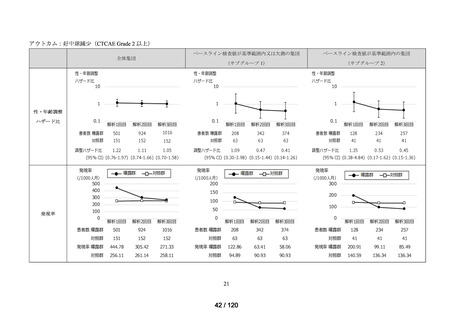
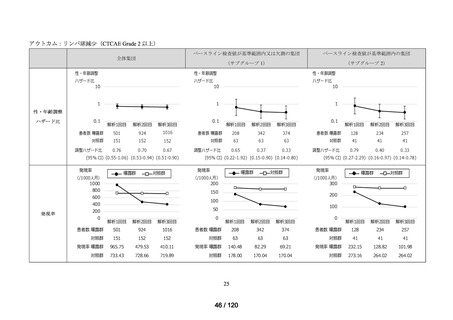
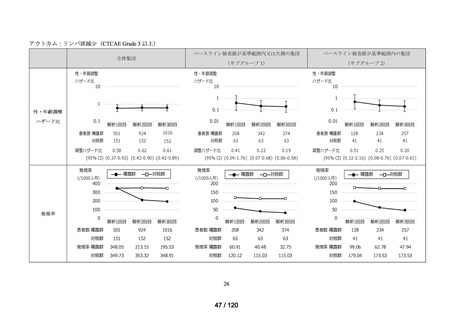
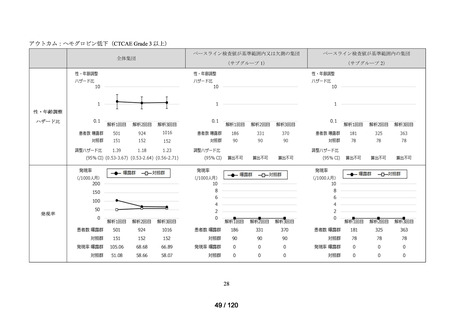
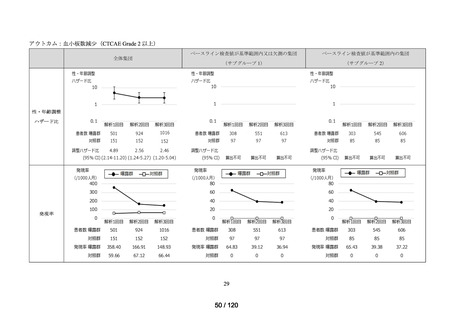
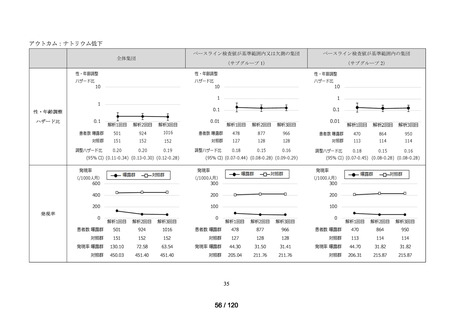
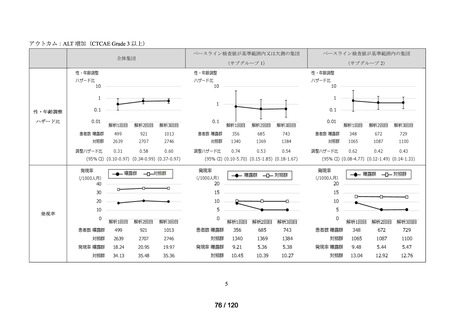
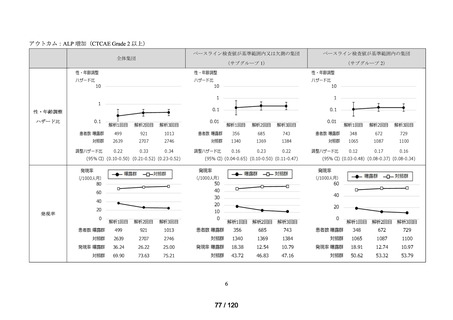
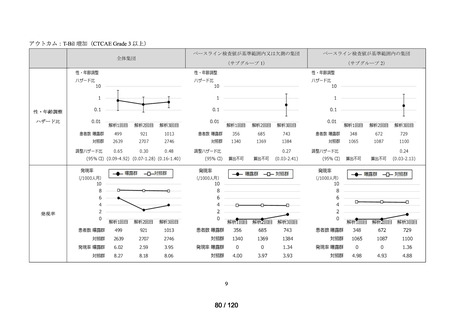
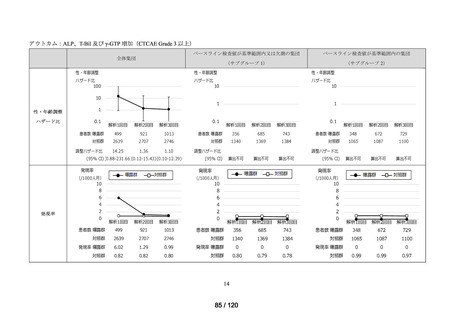
資料2-3 MID-NET・NDBの行政利活用の調査実施状況について[25.3MB] (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33888.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第1回 6/29)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
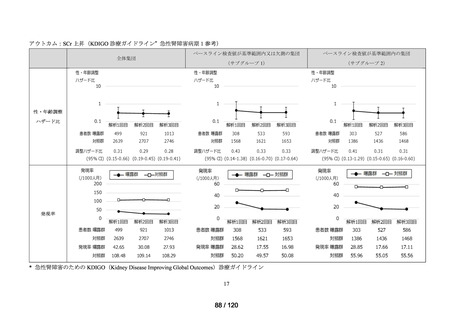
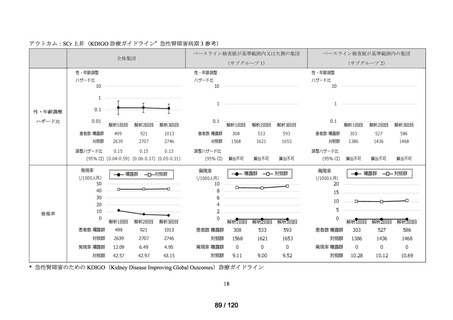
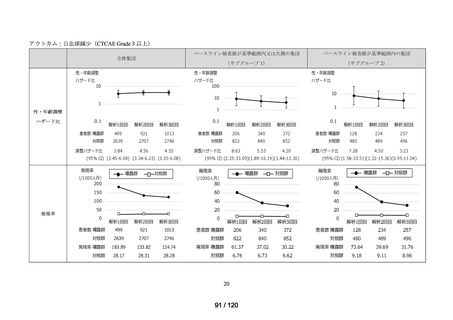
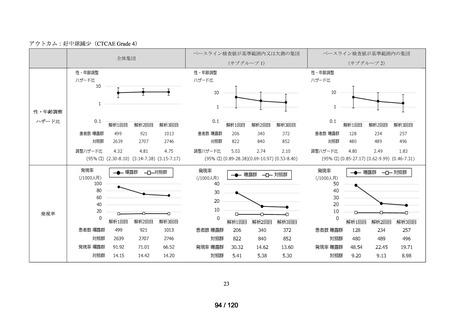
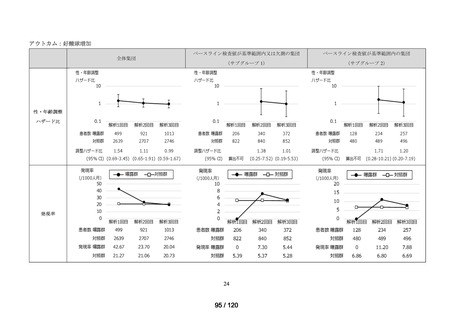
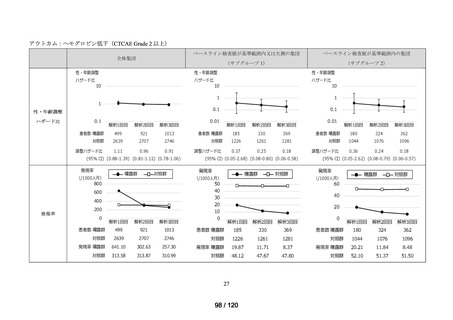
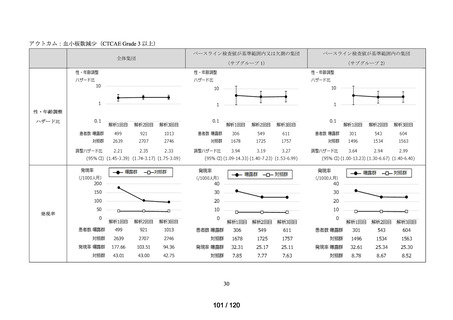
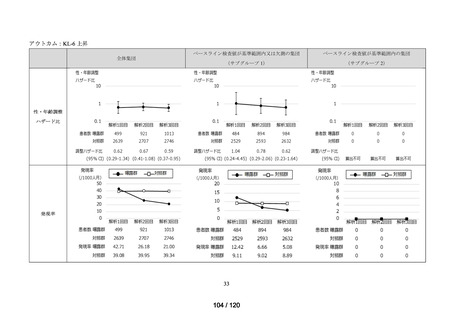
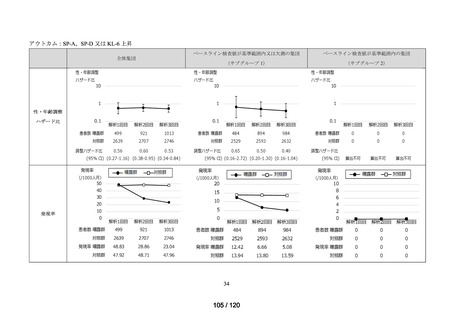
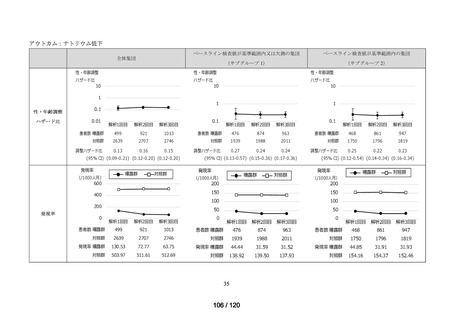
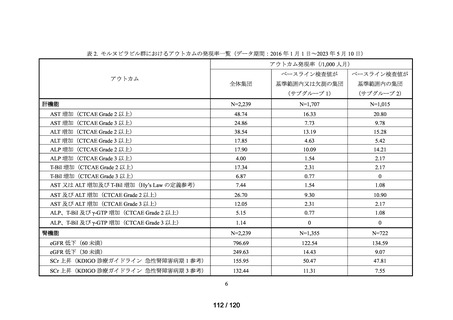
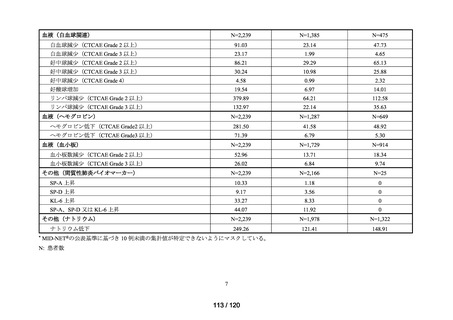
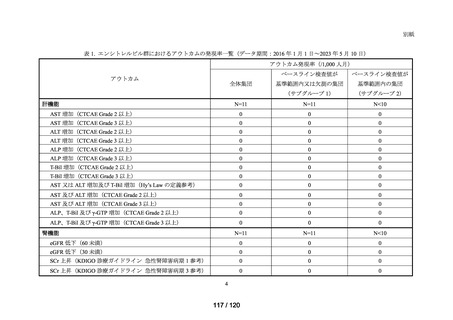
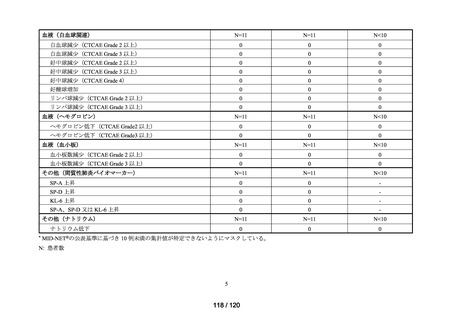
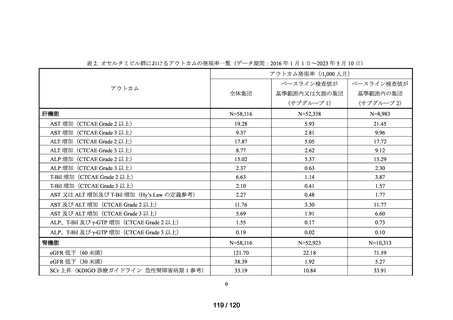
MID-NET®を用いた調査結果の概要
2023 年 6 月 28 日
調査・研究
の名称
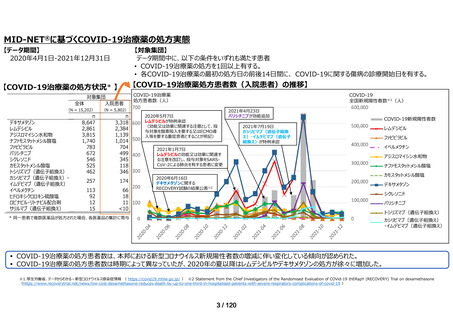
MID-NET®に基づく COVID-19 治療薬の処方実態調査及びベネフィット・リスク評価
調査対象
2021 年 7 月時点で、本邦で COVID-19 治療薬として処方され得た以下の医薬品(以下、
品目
「COVID-19 治療薬」)
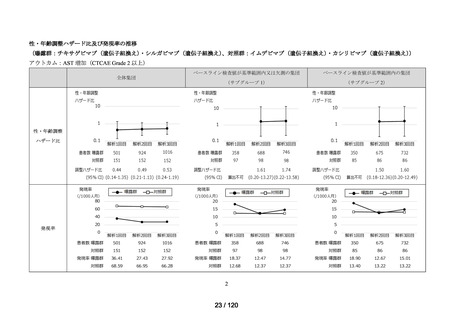
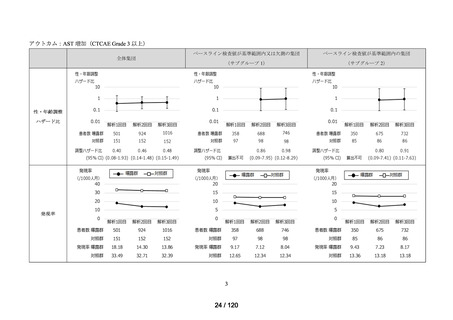
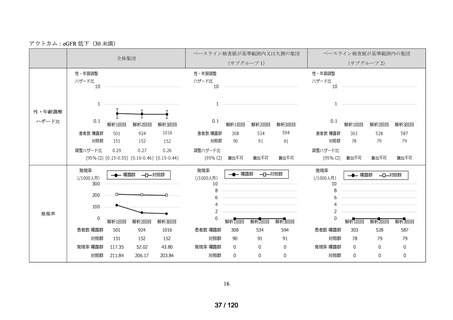
アジスロマイシン水和物、イベルメクチン、カシリビマブ(遺伝子組換え)・イムデビ
マブ(遺伝子組換え)、カモスタットメシル酸塩、サリルマブ(遺伝子組換え)、シク
レソニド、デキサメタゾン、トシリズマブ(遺伝子組換え)、ナファモスタットメシル
酸塩、バリシチニブ、ヒドロキシクロロキン硫酸塩、ファビピラビル、レムデシビル、
ロピナビル・リトナビル配合剤
調査背景
2020 年 1 月 16 日に本邦で初めて患者が確認された新型コロナウイルス感染症(以
下、「COVID-19」)の治療においては、当初は特異的な治療法が確立していなかっ
たことから、既存の薬剤が適応外で利用されてきた。
2020 年 5 月 7 日にはレムデシビルが COVID-19 治療薬として初めて特例承認され
た。新たなエビデンスの報告等を踏まえ、COVID-19 治療として推奨される医薬品
は更新されているものの、本邦における実臨床での処方実態の情報は不十分である。
調査目的
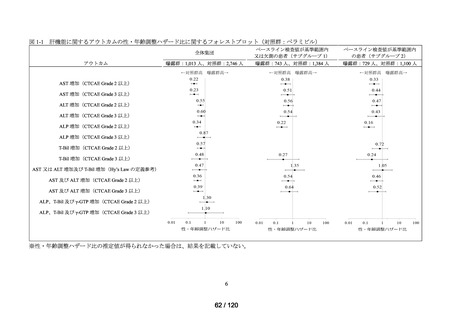
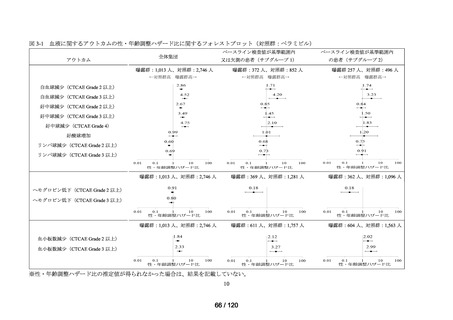
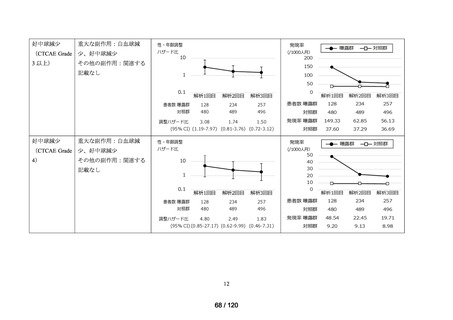
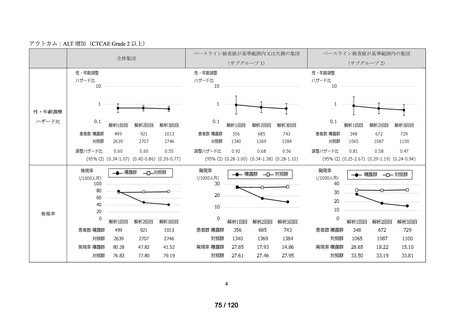
ベネフィット・リスク評価に先立ち、医薬品の適正使用の観点から、COVID-19 治療薬
の処方分布、処方推移及び各 COVID-19 治療薬が処方された集団の背景情報等から、
COVID-19 治療薬の処方実態を把握する。
MID-NET®
の選定理
由とデー
タ期間
調査方法
の概略
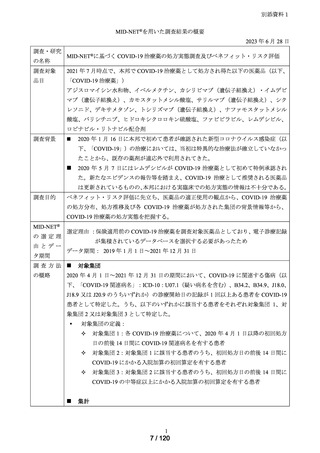
選定理由 :保険適用前の COVID-19 治療薬を調査対象医薬品としており、電子診療記録
が集積されているデータベースを選択する必要があったため
データ期間: 2019 年 1 月 1 日~2021 年 12 月 31 日
対象集団
2020 年 4 月 1 日~2021 年 12 月 31 日の期間において、COVID-19 に関連する傷病(以
下、「COVID-19 関連病名」:ICD-10:U07.1(疑い病名を含む)、B34.2、B34.9、J18.0、
J18.9 又は J20.9 のうちいずれか)の診療開始日の記録が 1 回以上ある患者を COVID-19
患者として特定した。うち、以下のいずれかに該当する患者をそれぞれ対象集団 1、対
象集団 2 又は対象集団 3 として特定した。
対象集団の定義:
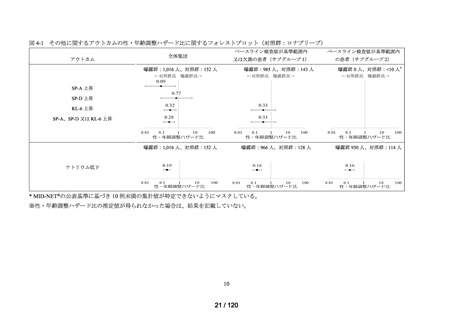
対象集団 1:各 COVID-19 治療薬について、2020 年 4 月 1 日以降の初回処方
日の前後 14 日間に COVID-19 関連病名を有する患者
対象集団 2:対象集団 1 に該当する患者のうち、初回処方日の前後 14 日間に
COVID-19 にかかる入院加算の初回算定を有する患者
対象集団 3:対象集団 2 に該当する患者のうち、初回処方日の前後 14 日間に
COVID-19 の中等症以上にかかる入院加算の初回算定を有する患者
集計
1
7 / 120