よむ、つかう、まなぶ。
【参考資料3-2】独立行政法人医薬品医療機器総合機構中期目標 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38892.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第9回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
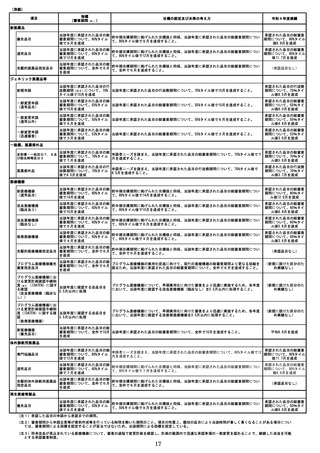
2
諸外国と信頼関係を構築するためには、個々に要望や状況が異なる相手に配慮し
つつ、国及び機構としてのベネフィットと同時に、相手のベネフィットも確保する
「Win-Win」の関係を構築する必要がある。さらに、今後は各国の規制当局との関係
強化だけでなく、海外のベンチャー企業等に対する「ドラッグロス」解消などに向
けた取組が求められ、困難度が高い。
4
安全対策業務
安全対策業務については、国民が国際的水準にある医薬品・医療機器等を安心して用
いることができるよう、医薬品・医療機器等をより早く安全に医療現場に届けるととも
に、医薬品・医療機器等が適正に使用されることを確保し、保健衛生上の危害発生の防
止及び発生時の迅速かつ的確な対応を行うことが重要である。
また、条件付き早期承認制度、緊急承認制度(注 11)等の医薬品・医療機器等の早期承認
を進める制度が整備される中、国民が安心して世界最先端の医薬品・医療機器等の恩恵
を受けられるように、安全対策業務の一層の質の向上と高度化を推進する必要がある。
このため、以下の目標を設定する。
(注 11)緊急時において、安全性の確認を前提に、医薬品・医療機器等の有効性が推定されたとき
に、条件や期限付の承認を与える迅速な薬事承認の制度。
(1)副作用・不具合情報の適切な収集・整理・評価の実施
① MID-NETⓇ(注 12)等の医療情報データベースを活用した薬剤疫学調査に基づく安全性
評価の推進を図ること。
② 副作用・不具合報告の迅速な整理・評価を実施すること。
③ 医療機関報告の充実のための普及啓発活動の推進を図ること。
④ 患者からの副作用情報の安全対策への活用を図ること。
(注 12)機構が運営する医療情報データベースシステムのこと。協力医療機関が保有する電子的な医
療情報を収集、分析システムを構築し、安全対策への利活用を進める。
(2)医療関係者並びに患者及び一般消費者への安全性情報の提供と講じた安全対策措置
のフォローアップ
① 最新の電子化された添付文書の確実な提供を図ること。
② 一般消費者や患者に必要な情報を分かりやすい形で発信するなど、リスクコミュ
ニケーションの強化を図ること。
③ RMP(注 13)を含む安全性情報の医療現場における更なる活用推進を図ること。
(注 13)開発から市販後までの一連のリスク管理についてまとめた文書(医薬品リスク管理計画書
(Risk Management Plan)の略)。
(3)審査部門及び救済部門との連携
① 市販後安全対策の視点で審査時の安全性評価・リスク管理計画の策定等を行うと
ともに、審査時の論点を市販後安全対策に活かすことで、審査段階から製造販売後ま
での一貫した安全対策につながるよう、審査部門との連携を図ること。
9
諸外国と信頼関係を構築するためには、個々に要望や状況が異なる相手に配慮し
つつ、国及び機構としてのベネフィットと同時に、相手のベネフィットも確保する
「Win-Win」の関係を構築する必要がある。さらに、今後は各国の規制当局との関係
強化だけでなく、海外のベンチャー企業等に対する「ドラッグロス」解消などに向
けた取組が求められ、困難度が高い。
4
安全対策業務
安全対策業務については、国民が国際的水準にある医薬品・医療機器等を安心して用
いることができるよう、医薬品・医療機器等をより早く安全に医療現場に届けるととも
に、医薬品・医療機器等が適正に使用されることを確保し、保健衛生上の危害発生の防
止及び発生時の迅速かつ的確な対応を行うことが重要である。
また、条件付き早期承認制度、緊急承認制度(注 11)等の医薬品・医療機器等の早期承認
を進める制度が整備される中、国民が安心して世界最先端の医薬品・医療機器等の恩恵
を受けられるように、安全対策業務の一層の質の向上と高度化を推進する必要がある。
このため、以下の目標を設定する。
(注 11)緊急時において、安全性の確認を前提に、医薬品・医療機器等の有効性が推定されたとき
に、条件や期限付の承認を与える迅速な薬事承認の制度。
(1)副作用・不具合情報の適切な収集・整理・評価の実施
① MID-NETⓇ(注 12)等の医療情報データベースを活用した薬剤疫学調査に基づく安全性
評価の推進を図ること。
② 副作用・不具合報告の迅速な整理・評価を実施すること。
③ 医療機関報告の充実のための普及啓発活動の推進を図ること。
④ 患者からの副作用情報の安全対策への活用を図ること。
(注 12)機構が運営する医療情報データベースシステムのこと。協力医療機関が保有する電子的な医
療情報を収集、分析システムを構築し、安全対策への利活用を進める。
(2)医療関係者並びに患者及び一般消費者への安全性情報の提供と講じた安全対策措置
のフォローアップ
① 最新の電子化された添付文書の確実な提供を図ること。
② 一般消費者や患者に必要な情報を分かりやすい形で発信するなど、リスクコミュ
ニケーションの強化を図ること。
③ RMP(注 13)を含む安全性情報の医療現場における更なる活用推進を図ること。
(注 13)開発から市販後までの一連のリスク管理についてまとめた文書(医薬品リスク管理計画書
(Risk Management Plan)の略)。
(3)審査部門及び救済部門との連携
① 市販後安全対策の視点で審査時の安全性評価・リスク管理計画の策定等を行うと
ともに、審査時の論点を市販後安全対策に活かすことで、審査段階から製造販売後ま
での一貫した安全対策につながるよう、審査部門との連携を図ること。
9