よむ、つかう、まなぶ。
総-2-1○医薬品の新規薬価収載等について (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00251.html |
| 出典情報 | 中央社会保険医療協議会 総会(第587回 4/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
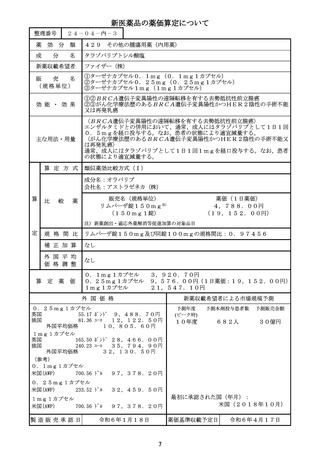
薬価算定組織における検討結果のまとめ
算定方式
類似薬効比較方式(Ⅰ)
第一回算定組織
新
成分名
最
類
似
薬
選
定
の
妥
当
性
薬
令和6年3月19日
最類似薬
シロリムス
左に同じ
イ.効能・効果
○リンパ脈管筋腫症
○下記の難治性脈管腫瘍及び難治性脈管奇
○下記の難治性脈管腫瘍及び難治性脈管奇
形
形
リンパ管腫(リンパ管奇形)、リンパ管腫症、
リンパ管腫(リンパ管奇形)、リンパ管腫症、
ゴーハム病、リンパ管拡張症
ゴーハム病、リンパ管拡張症
血管内皮腫、房状血管腫
血管内皮腫、房状血管腫
静脈奇形、青色ゴムまり様母斑症候群
静脈奇形、青色ゴムまり様母斑症候群
混合型脈管奇形、クリッペル・トレノネー・
混合型脈管奇形、クリッペル・トレノネー・
ウェーバー症候群
ウェーバー症候群
ロ.薬理作用
mTOR阻害作用
左に同じ
ハ.組成及び
化学構造
左に同じ
ニ.投与形態
剤形
用法
内用
顆粒剤
1日1回
画 期 性 加 算
(70~120%)
該当しない
有用性加算(Ⅰ)
(35~60%)
該当しない
左に同じ
錠剤
左に同じ
該当する(A=15%)
有用性加算(Ⅱ)
(5~30%)
補
正
加
算
〔ハ.治療方法の改善(不十分例、標準的治療法、重篤な疾病): ③-a,③-b, ③-h=3p〕
国内のガイドラインにおいて本剤を用いた治療法が優先的に考慮されると記載されて
いること、適応疾患の治療法が確立していないこと等から、有用性加算(Ⅱ)
(A=15%)
を適用することが適当と判断した。
市場性加算(Ⅰ)
(10~20%)
該当しない
市場性加算(Ⅱ)
(5%)
該当しない
特 定 用 途 加 算
(5~20%)
該当しない
小
児
加
算
(5~20%)
該当しない
先
駆
加
算
(10~20%)
該当しない
迅 速 導 入 加 算
(5~10%)
該当しない
新薬創出・適応外薬
解 消 等 促 進 加 算
該当する(主な理由:希少疾病用医薬品として指定)
費用対効果評価への
該
当
性
該当しない
当初算定案に対する
新 薬 収 載 希 望 者 の
不 服 意 見 の 要 点
・本剤と比較薬は生物学的に同等ではなく、本剤の1日通常最大単位数量は比較薬の0.8
倍とすることが適当。
・本剤の対象疾患には、これまで治療薬が存在せず外科的手術等の実施困難な場合があるこ
と、乳幼児を含む小児患者に対し体格に応じた細かな投与量設定をするために顆粒剤が有
用であることを踏まえ、有用性加算の要件③-aを満たす。
第二回算定組織
上 記 不 服 意 見 に
対
す
る
見
解
令和6年3月26日
・本剤と比較薬の0.8倍量が生物学的に同等であることを示すデータはなく、薬事承認さ
れた用法・用量に基づき、本剤と比較薬の1日通常最大単位数量は同一として扱うのが適
当と判断する。
・本剤の対象疾患の特性、小児に対する医薬品であること等を踏まえ、総合的に判断し、顆
粒剤である本剤は有用性加算の要件③-aに該当する。
10
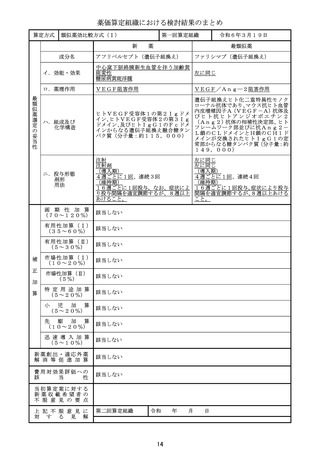
算定方式
類似薬効比較方式(Ⅰ)
第一回算定組織
新
成分名
最
類
似
薬
選
定
の
妥
当
性
薬
令和6年3月19日
最類似薬
シロリムス
左に同じ
イ.効能・効果
○リンパ脈管筋腫症
○下記の難治性脈管腫瘍及び難治性脈管奇
○下記の難治性脈管腫瘍及び難治性脈管奇
形
形
リンパ管腫(リンパ管奇形)、リンパ管腫症、
リンパ管腫(リンパ管奇形)、リンパ管腫症、
ゴーハム病、リンパ管拡張症
ゴーハム病、リンパ管拡張症
血管内皮腫、房状血管腫
血管内皮腫、房状血管腫
静脈奇形、青色ゴムまり様母斑症候群
静脈奇形、青色ゴムまり様母斑症候群
混合型脈管奇形、クリッペル・トレノネー・
混合型脈管奇形、クリッペル・トレノネー・
ウェーバー症候群
ウェーバー症候群
ロ.薬理作用
mTOR阻害作用
左に同じ
ハ.組成及び
化学構造
左に同じ
ニ.投与形態
剤形
用法
内用
顆粒剤
1日1回
画 期 性 加 算
(70~120%)
該当しない
有用性加算(Ⅰ)
(35~60%)
該当しない
左に同じ
錠剤
左に同じ
該当する(A=15%)
有用性加算(Ⅱ)
(5~30%)
補
正
加
算
〔ハ.治療方法の改善(不十分例、標準的治療法、重篤な疾病): ③-a,③-b, ③-h=3p〕
国内のガイドラインにおいて本剤を用いた治療法が優先的に考慮されると記載されて
いること、適応疾患の治療法が確立していないこと等から、有用性加算(Ⅱ)
(A=15%)
を適用することが適当と判断した。
市場性加算(Ⅰ)
(10~20%)
該当しない
市場性加算(Ⅱ)
(5%)
該当しない
特 定 用 途 加 算
(5~20%)
該当しない
小
児
加
算
(5~20%)
該当しない
先
駆
加
算
(10~20%)
該当しない
迅 速 導 入 加 算
(5~10%)
該当しない
新薬創出・適応外薬
解 消 等 促 進 加 算
該当する(主な理由:希少疾病用医薬品として指定)
費用対効果評価への
該
当
性
該当しない
当初算定案に対する
新 薬 収 載 希 望 者 の
不 服 意 見 の 要 点
・本剤と比較薬は生物学的に同等ではなく、本剤の1日通常最大単位数量は比較薬の0.8
倍とすることが適当。
・本剤の対象疾患には、これまで治療薬が存在せず外科的手術等の実施困難な場合があるこ
と、乳幼児を含む小児患者に対し体格に応じた細かな投与量設定をするために顆粒剤が有
用であることを踏まえ、有用性加算の要件③-aを満たす。
第二回算定組織
上 記 不 服 意 見 に
対
す
る
見
解
令和6年3月26日
・本剤と比較薬の0.8倍量が生物学的に同等であることを示すデータはなく、薬事承認さ
れた用法・用量に基づき、本剤と比較薬の1日通常最大単位数量は同一として扱うのが適
当と判断する。
・本剤の対象疾患の特性、小児に対する医薬品であること等を踏まえ、総合的に判断し、顆
粒剤である本剤は有用性加算の要件③-aに該当する。
10