よむ、つかう、まなぶ。
総-2-1○医薬品の新規薬価収載等について (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00251.html |
| 出典情報 | 中央社会保険医療協議会 総会(第587回 4/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
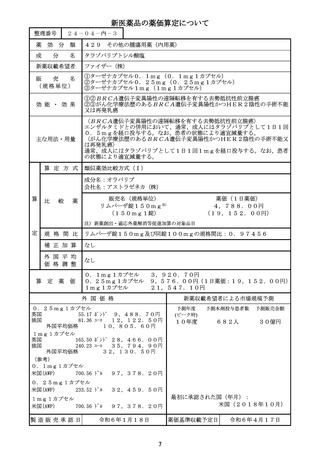
薬価算定組織における検討結果のまとめ
算定方式
類似薬効比較方式(Ⅰ)
第一回算定組織
新
成分名
最
類
似
薬
選
定
の
妥
当
性
補
正
加
算
令和6年3月19日
薬
最類似薬
エフガルチギモド アルファ(遺伝子組換え)・ボル エフガルチギモド
ヒアルロニダーゼ アルファ(遺伝子組換え)
伝子組換え)
アルファ(遺
イ.効能・効果
全身型重症筋無力症(ステロイド剤又はステロイド剤
左に同じ
以外の免疫抑制剤が十分に奏効しない場合に限る)
ロ.薬理作用
抗胎児性Fc受容体(FcRn)作用
ハ.組成及び
化学構造
・227個のアミノ酸残基からなるサブユニット2
227個のアミノ酸残基からなる
個から構成される糖タンパク質(分子量:約54,
サブユニット2個から構成される
000)
糖タンパク質(分子量:約54,0
・447個のアミノ酸残基からなる糖タンパク質(分
00)
子量:60,000~65,000)
ニ.投与形態
剤形
用法
注射
注射剤
1週に1回
画 期 性 加 算
(70~120%)
該当しない
有用性加算(Ⅰ)
(35~60%)
該当しない
有用性加算(Ⅱ)
(5~30%)
該当しない
市場性加算(Ⅰ)
(10~20%)
該当しない
市場性加算(Ⅱ)
(5%)
該当しない
特 定 用 途 加 算
(5~20%)
該当しない
小
児
加
算
(5~20%)
該当しない
先
駆
加
算
(10~20%)
該当しない
迅 速 導 入 加 算
(5~10%)
該当しない
左に同じ
左に同じ
左に同じ
左に同じ
新薬創出・適応外薬
解 消 等 促 進 加 算
該当する(先行収載品と組成及び効能又は効果が同等であって、製造販売業者が同一)
費用対効果評価への
該
当
性
該当しない
当初算定案に対する
新 薬 収 載 希 望 者 の
不 服 意 見 の 要 点
・比較の一日薬価の算出に用いる体重は、「50kg」ではなく、比較薬で市販後に実施
中の特定使用成績調査の患者集団における体重の平均値が適当。
・本剤による投与時間の短縮及び在宅自己注射による通院頻度の減少は、重症筋無力症患
者のアンメットニーズの改善につながる。
・新薬創出・適応外薬解消等促進加算の対象品目の要件⑪『本規定に基づく加算の対象品
目(以下「先行収載品」という。)と組成及び効能又は効果が同等であって、製造販売業
者が同一である医薬品(当該先行収載品の収載から遅滞なく(概ね5年以内)収載された
ものに限り、①から⑩までに該当するものを除く。)』に該当する。
第二回算定組織
上 記 不 服 意 見 に
対
す
る
見
解
令和6年3月26日
・比較薬の1日通常最大単位数量は、使用成績調査における患者の体重の平均値を用いて
算出することが適当と判断する。
・既存の静注製剤に比べて投与時間は減ったものの、投与頻度は1週間に1回で変わらな
いこと、審査報告書において「既存の治療法の安全性プロファイルや投与方法の異同も
踏まえ、患者の症状・状態に応じて、医療現場で適切に使い分けられるものと判断する。」
と評価されていることを踏まえると、使用に際しての利便性が著しく高いとまでは判断
できず、有用性加算の要件③-cには該当しない。
・新薬創出・適応外薬解消等促進加算の対象品目の要件⑪に該当する。
22
算定方式
類似薬効比較方式(Ⅰ)
第一回算定組織
新
成分名
最
類
似
薬
選
定
の
妥
当
性
補
正
加
算
令和6年3月19日
薬
最類似薬
エフガルチギモド アルファ(遺伝子組換え)・ボル エフガルチギモド
ヒアルロニダーゼ アルファ(遺伝子組換え)
伝子組換え)
アルファ(遺
イ.効能・効果
全身型重症筋無力症(ステロイド剤又はステロイド剤
左に同じ
以外の免疫抑制剤が十分に奏効しない場合に限る)
ロ.薬理作用
抗胎児性Fc受容体(FcRn)作用
ハ.組成及び
化学構造
・227個のアミノ酸残基からなるサブユニット2
227個のアミノ酸残基からなる
個から構成される糖タンパク質(分子量:約54,
サブユニット2個から構成される
000)
糖タンパク質(分子量:約54,0
・447個のアミノ酸残基からなる糖タンパク質(分
00)
子量:60,000~65,000)
ニ.投与形態
剤形
用法
注射
注射剤
1週に1回
画 期 性 加 算
(70~120%)
該当しない
有用性加算(Ⅰ)
(35~60%)
該当しない
有用性加算(Ⅱ)
(5~30%)
該当しない
市場性加算(Ⅰ)
(10~20%)
該当しない
市場性加算(Ⅱ)
(5%)
該当しない
特 定 用 途 加 算
(5~20%)
該当しない
小
児
加
算
(5~20%)
該当しない
先
駆
加
算
(10~20%)
該当しない
迅 速 導 入 加 算
(5~10%)
該当しない
左に同じ
左に同じ
左に同じ
左に同じ
新薬創出・適応外薬
解 消 等 促 進 加 算
該当する(先行収載品と組成及び効能又は効果が同等であって、製造販売業者が同一)
費用対効果評価への
該
当
性
該当しない
当初算定案に対する
新 薬 収 載 希 望 者 の
不 服 意 見 の 要 点
・比較の一日薬価の算出に用いる体重は、「50kg」ではなく、比較薬で市販後に実施
中の特定使用成績調査の患者集団における体重の平均値が適当。
・本剤による投与時間の短縮及び在宅自己注射による通院頻度の減少は、重症筋無力症患
者のアンメットニーズの改善につながる。
・新薬創出・適応外薬解消等促進加算の対象品目の要件⑪『本規定に基づく加算の対象品
目(以下「先行収載品」という。)と組成及び効能又は効果が同等であって、製造販売業
者が同一である医薬品(当該先行収載品の収載から遅滞なく(概ね5年以内)収載された
ものに限り、①から⑩までに該当するものを除く。)』に該当する。
第二回算定組織
上 記 不 服 意 見 に
対
す
る
見
解
令和6年3月26日
・比較薬の1日通常最大単位数量は、使用成績調査における患者の体重の平均値を用いて
算出することが適当と判断する。
・既存の静注製剤に比べて投与時間は減ったものの、投与頻度は1週間に1回で変わらな
いこと、審査報告書において「既存の治療法の安全性プロファイルや投与方法の異同も
踏まえ、患者の症状・状態に応じて、医療現場で適切に使い分けられるものと判断する。」
と評価されていることを踏まえると、使用に際しての利便性が著しく高いとまでは判断
できず、有用性加算の要件③-cには該当しない。
・新薬創出・適応外薬解消等促進加算の対象品目の要件⑪に該当する。
22