よむ、つかう、まなぶ。
04【資料2】新型コロナワクチンの接種について (62 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000192554_00021.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第31回 3/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
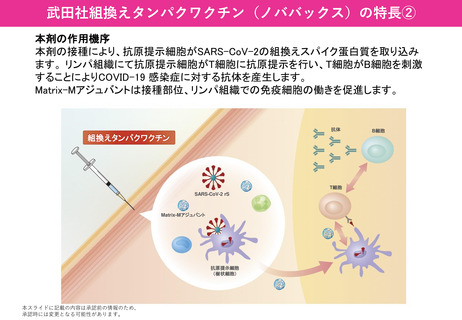
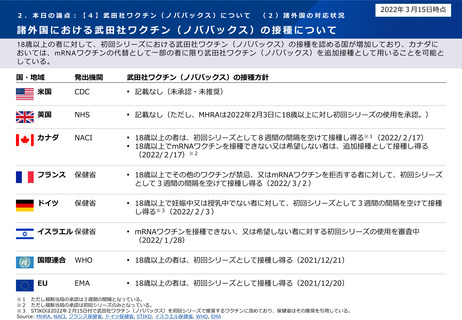
2.本日の論点:【4】武田社ワクチン(ノババックス)について
(1)武田社ワクチン(ノババックス)の有効性、安全性
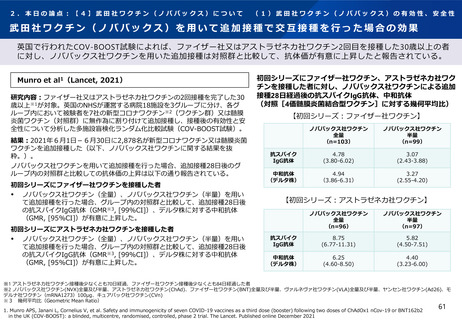
武田社ワクチン(ノババックス)を用いて追加接種で交互接種を行った場合の安全性
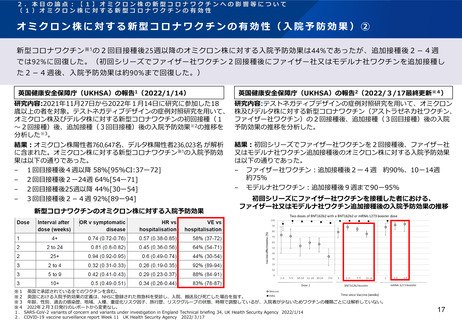
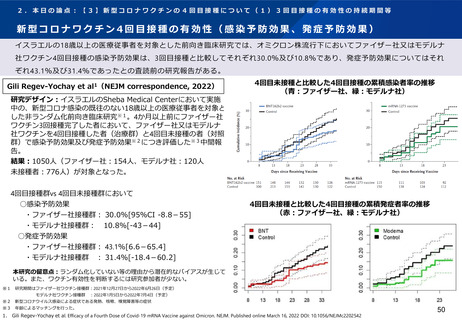
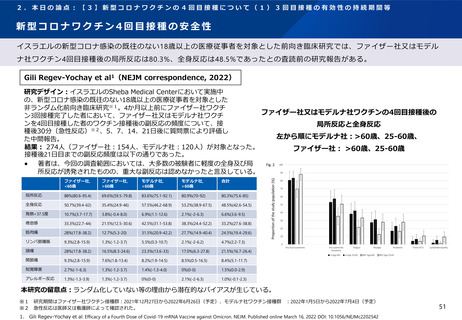
英国で行われたCOV-BOOST試験によれば、ファイザー社又はアストラゼネカ社ワクチン2回目を接種した30歳以上の者に対す
るノババックス社ワクチンを用いた追加接種を行った後、研究期間中に報告された副反応は、安全性の面で許容されると報告
されている。
Munro et al1(Lancet, 2021)
研究内容:ファイザー社又はアストラゼネカ社ワクチンの2回接種を完了した30歳以上
※1が対象。英国のNHSが運営する病院18施設を3グループに分け、各グループ内におい
て被験者を7社の新型コロナワクチン※2(ワクチン群)又は髄膜炎菌ワクチン(対照
群)に無作為に割り付けて追加接種し、接種後の有効性と安全性について分析した多
施設盲検化ランダム化比較試験(COV-BOOST試験)。
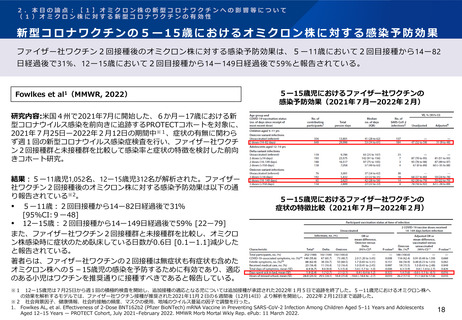
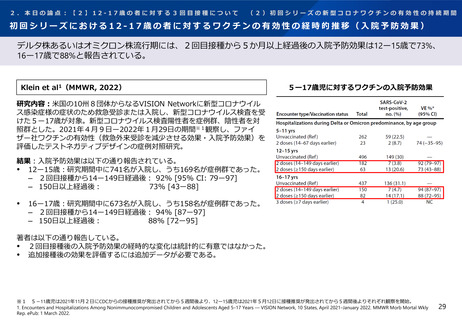
追加接種後2021年8月19日までに報告された副反応
初回シリーズ:アストラゼネカ社ワクチン(左)ファイザー社ワクチン(右)
結果: 2021年6月1日-6月30日に2,878名が新型コロナワクチン又は髄膜炎菌ワクチン
を追加接種した。2021年8月19日までに報告された副反応は以下の通りであった(以
下、ノババックス社ワクチンに関する結果を抜粋。) 。
初回シリーズにアストラゼネカ社ワクチンを接種した者
‒
ノババックス社ワクチン全量接種者で37人(115人中)、半量接種者で37人
(108人中)に副反応(すべての重症度)が報告された。
‒
AESI※3は報告されず、重篤な副反応はすべてワクチンと関連性がないと報告
された。
初回シリーズにファイザー社ワクチンを接種した者
‒
ノババックス社ワクチン全量接種者で44人(114人中)、半量接種者で41人
(112人中)に副反応(すべての重症度)が報告された。
‒
AESI※3は報告されず、重篤な副反応はすべてワクチンと関連性がないと報告
された。
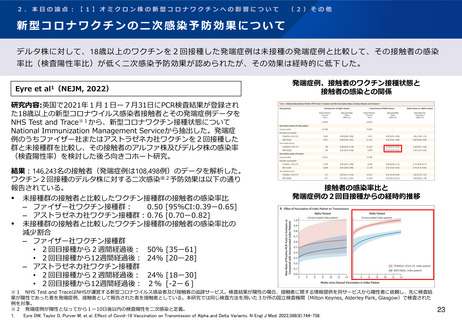
著者らは、すべてのワクチンの組み合わせで副反応は同様で、安全性の面で許容され
ると報告している。
※1 アストラゼネカ社ワクチン接種後少なくとも70日経過、ファイザー社ワクチン接種後少なくとも84日経過した者
※2 ノババックス社ワクチン(NVX)全量及び半量、アストラゼネカ社ワクチン(ChAd)、ファイザー社ワクチン(BNT)全量及び半量、ヴァルネヴァ社ワクチン(VLA)全量及び半量、ヤンセン社ワクチン
(Ad26)、モデルナ社ワクチン(mRNA1273)100μg、キュアバック社ワクチン(CVn)
※3 Adverse Events of Special Interest. 追加接種後14日以内の新型コロナ発症と重篤な副反応を除く
62
1. Munro APS, Janani L, Cornelius V, et al. Safety and immunogenicity of seven COVID-19 vaccines as a third dose (booster) following two doses of ChAdOx1 nCov-19 or BNT162b2 in the UK (COVBOOST): a blinded, multicentre, randomised, controlled, phase 2 trial. The Lancet. Published online December 2021
(1)武田社ワクチン(ノババックス)の有効性、安全性
武田社ワクチン(ノババックス)を用いて追加接種で交互接種を行った場合の安全性
英国で行われたCOV-BOOST試験によれば、ファイザー社又はアストラゼネカ社ワクチン2回目を接種した30歳以上の者に対す
るノババックス社ワクチンを用いた追加接種を行った後、研究期間中に報告された副反応は、安全性の面で許容されると報告
されている。
Munro et al1(Lancet, 2021)
研究内容:ファイザー社又はアストラゼネカ社ワクチンの2回接種を完了した30歳以上
※1が対象。英国のNHSが運営する病院18施設を3グループに分け、各グループ内におい
て被験者を7社の新型コロナワクチン※2(ワクチン群)又は髄膜炎菌ワクチン(対照
群)に無作為に割り付けて追加接種し、接種後の有効性と安全性について分析した多
施設盲検化ランダム化比較試験(COV-BOOST試験)。
追加接種後2021年8月19日までに報告された副反応
初回シリーズ:アストラゼネカ社ワクチン(左)ファイザー社ワクチン(右)
結果: 2021年6月1日-6月30日に2,878名が新型コロナワクチン又は髄膜炎菌ワクチン
を追加接種した。2021年8月19日までに報告された副反応は以下の通りであった(以
下、ノババックス社ワクチンに関する結果を抜粋。) 。
初回シリーズにアストラゼネカ社ワクチンを接種した者
‒
ノババックス社ワクチン全量接種者で37人(115人中)、半量接種者で37人
(108人中)に副反応(すべての重症度)が報告された。
‒
AESI※3は報告されず、重篤な副反応はすべてワクチンと関連性がないと報告
された。
初回シリーズにファイザー社ワクチンを接種した者
‒
ノババックス社ワクチン全量接種者で44人(114人中)、半量接種者で41人
(112人中)に副反応(すべての重症度)が報告された。
‒
AESI※3は報告されず、重篤な副反応はすべてワクチンと関連性がないと報告
された。
著者らは、すべてのワクチンの組み合わせで副反応は同様で、安全性の面で許容され
ると報告している。
※1 アストラゼネカ社ワクチン接種後少なくとも70日経過、ファイザー社ワクチン接種後少なくとも84日経過した者
※2 ノババックス社ワクチン(NVX)全量及び半量、アストラゼネカ社ワクチン(ChAd)、ファイザー社ワクチン(BNT)全量及び半量、ヴァルネヴァ社ワクチン(VLA)全量及び半量、ヤンセン社ワクチン
(Ad26)、モデルナ社ワクチン(mRNA1273)100μg、キュアバック社ワクチン(CVn)
※3 Adverse Events of Special Interest. 追加接種後14日以内の新型コロナ発症と重篤な副反応を除く
62
1. Munro APS, Janani L, Cornelius V, et al. Safety and immunogenicity of seven COVID-19 vaccines as a third dose (booster) following two doses of ChAdOx1 nCov-19 or BNT162b2 in the UK (COVBOOST): a blinded, multicentre, randomised, controlled, phase 2 trial. The Lancet. Published online December 2021
関連画像
ページ内で利用されている画像ファイルです。
有料会員登録をして頂くことで、このページ内で利用されている画像を個別に閲覧・ダウンロードすることができるようになります。
有料会員登録のお問い合わせはこちらから。