よむ、つかう、まなぶ。
参考資料 2 血漿分画製剤のウイルスに対する安全性確保に関するガイドラインの一部改正について(令和6年3月 29 日付け医薬発 0329 第 16 号厚生労働省医薬局長通知) (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40647.html |
| 出典情報 | 薬事審議会 血液事業部会運営委員会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
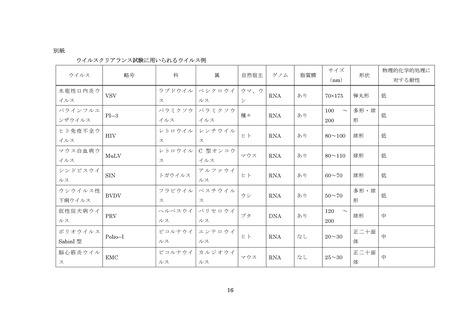
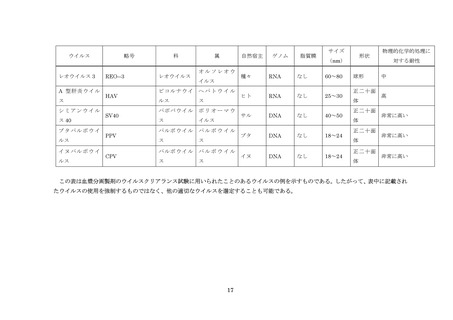
るアッセイ法を用いる必要がある。
(5)試料中に添加するウイルス量は、その製造工程のウイルスクリアランス能を充分に評
価できる量とする。ただし、一般的にウイルスの添加量は、ウイルス溶液量として出発
原料の 10%以下とすること。
(6)試料中のウイルスは、可能な限り超遠心分離、透析、保存などの操作を行わずに定量
することが望ましい。しかし、試験に対する阻害物質や使用する細胞に対する毒性物質
を除去するため、又は全ての試料を同時に定量するため、定量前に何らかの処理をする
ことが避けられない場合には、適切なコントロールを用いて、その処理の試験結果に対
する影響を確認するとともに、試料による毒性発現などの検出系に対する影響も考慮
すること。
(7)ウイルスの選択にあたっては、ウイルスクリアランス試験従事者に健康被害をもたら
す可能性のあることに配慮すること。
4.4
ウイルスクリアランス能の評価
4.4.1 ウイルスクリアランス指数の評価
製造工程におけるウイルスクリアランス指数は、各製造段階での試験で得られたウイル
スクリアランス指数の総和で評価する。製造販売業者は、得られたウイルスクリアランス指
数が適切であるかどうかについて、原血漿及び製造過程に含まれる可能性のある全てのウ
イルスを念頭において評価し、その妥当性を示すべきである。
4.4.2 ウイルスクリアランス指数の計算法
ウイルス除去工程及び不活化工程のウイルスクリアランス指数 R は、次式で示される。
R=log(
(V1×T1)/(V2×T2)
)
なお、R は対数で表される減少度、V1 は工程処理前の容量、T1 は工程処理前のウイルス
力価、V2 は工程処理後の試料の容量、T2 は工程処理後の試料のウイルス力価である。
ウイルスクリアランス指数を算出する場合には、可能な限り、添加したウイルス力価では
なく、添加後の工程処理前の原料中に検出されるウイルスを検証しなければならない。
試験のばらつきは、希釈誤差、統計的な原因、各種測定法に特有な未知又は制御不能な要
素の違いなどにより生じる。通常、独立して実施した試験間のばらつき(試験間変動)は、
一試験内のばらつき(試験内変動)より大きい。
処理工程前の材料中のウイルス定量値の信頼限界が+S で、工程処理後のウイルス定量値
の信頼限界が+a の場合、ウイルスクリアランス指数の信頼限界は±√(S2+a2)である。
上記の要因を総合的に評価することにより、当該工程のウイルスクリアランスの有効性
を適切に判断することができる。
8
10
(5)試料中に添加するウイルス量は、その製造工程のウイルスクリアランス能を充分に評
価できる量とする。ただし、一般的にウイルスの添加量は、ウイルス溶液量として出発
原料の 10%以下とすること。
(6)試料中のウイルスは、可能な限り超遠心分離、透析、保存などの操作を行わずに定量
することが望ましい。しかし、試験に対する阻害物質や使用する細胞に対する毒性物質
を除去するため、又は全ての試料を同時に定量するため、定量前に何らかの処理をする
ことが避けられない場合には、適切なコントロールを用いて、その処理の試験結果に対
する影響を確認するとともに、試料による毒性発現などの検出系に対する影響も考慮
すること。
(7)ウイルスの選択にあたっては、ウイルスクリアランス試験従事者に健康被害をもたら
す可能性のあることに配慮すること。
4.4
ウイルスクリアランス能の評価
4.4.1 ウイルスクリアランス指数の評価
製造工程におけるウイルスクリアランス指数は、各製造段階での試験で得られたウイル
スクリアランス指数の総和で評価する。製造販売業者は、得られたウイルスクリアランス指
数が適切であるかどうかについて、原血漿及び製造過程に含まれる可能性のある全てのウ
イルスを念頭において評価し、その妥当性を示すべきである。
4.4.2 ウイルスクリアランス指数の計算法
ウイルス除去工程及び不活化工程のウイルスクリアランス指数 R は、次式で示される。
R=log(
(V1×T1)/(V2×T2)
)
なお、R は対数で表される減少度、V1 は工程処理前の容量、T1 は工程処理前のウイルス
力価、V2 は工程処理後の試料の容量、T2 は工程処理後の試料のウイルス力価である。
ウイルスクリアランス指数を算出する場合には、可能な限り、添加したウイルス力価では
なく、添加後の工程処理前の原料中に検出されるウイルスを検証しなければならない。
試験のばらつきは、希釈誤差、統計的な原因、各種測定法に特有な未知又は制御不能な要
素の違いなどにより生じる。通常、独立して実施した試験間のばらつき(試験間変動)は、
一試験内のばらつき(試験内変動)より大きい。
処理工程前の材料中のウイルス定量値の信頼限界が+S で、工程処理後のウイルス定量値
の信頼限界が+a の場合、ウイルスクリアランス指数の信頼限界は±√(S2+a2)である。
上記の要因を総合的に評価することにより、当該工程のウイルスクリアランスの有効性
を適切に判断することができる。
8
10