よむ、つかう、まなぶ。
参考資料 2 血漿分画製剤のウイルスに対する安全性確保に関するガイドラインの一部改正について(令和6年3月 29 日付け医薬発 0329 第 16 号厚生労働省医薬局長通知) (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40647.html |
| 出典情報 | 薬事審議会 血液事業部会運営委員会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
血漿分画製剤を製造する際は、原血漿、その他の原料等及び製造環境に起因するウイルス
等による汚染の可能性を極力低減させるため、適切な製造環境、条件及び技術を採用しなけ
ればならない。
製造工程における原血漿以外からのウイルス汚染の可能性として以下のことが考えられ
る。
(1)製造従事者より汚染される。
(2)製造施設環境より汚染される。
(3)製造工程において用いる動物由来酵素やモノクローナル抗体等の原料等からウイルス
が混入する。
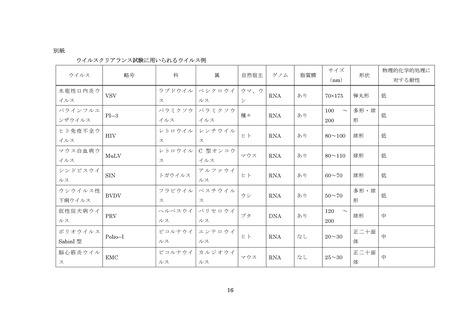
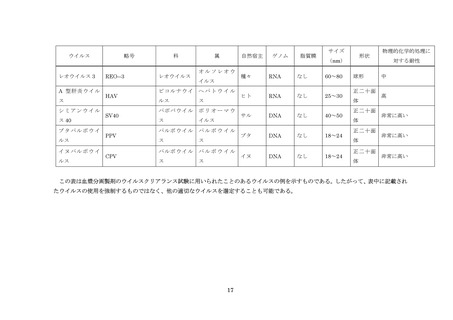
近年の技術進歩はめざましく、有用なウイルスの検査技術、ウイルスの除去技術及び不活
化技術については積極的に導入する必要がある。脂質膜を持つウイルスの除去・不活化につ
いては、可能な限り頑健性の高い 2 つ以上の原理が異なるウイルスクリアランス工程を導
入すること。脂質膜を持たないウイルスの除去・不活化については、頑健性の高いウイルス
クリアランス工程を少なくとも 1 工程導入するように努めること。また、製造工程にはウ
イルス安全性が確保された原料等を用いることにより、ウイルスの混入の可能性に対する
安全性を高める必要がある。
3.1
工程前検査
工程前検査の対象となるのは、一人の供血者の血液から製造された血漿、少人数の血漿を
プールしたミニプール血漿及びプール血漿である。一人の供血者の血液から製造された血
漿ではその特異性や感度、精度が十分に評価された試験法を用いて HBV、HCV 及び HIV
の血清学的検査を行うこと。ミニプール血漿及びプール血漿についても、その特異性、感度
及び精度が十分に評価された核酸増幅検査(Nucleic acid amplification test; NAT)を用い
て HBV、HCV 及び HIV の遺伝子検査を実施する。必要に応じて HBV、HCV、HIV 以外
のウイルスの試験の実施を考慮すること。既に採血時に個別 NAT 等による検査が行われて
いる場合にはその結果をもって工程前検査が実施されたものとみなすことができる。
3.2
中間血漿分画物(中間原料)の管理
血漿分画製剤を製造する際に使用する原料は必ずしも血漿とは限らず、中間原料製造業
者において製造された血漿由来の中間原料を、製剤の製造業者が原料として使用し、精製工
程を経て製品化することがある。例えば、クリオ沈殿物(血液凝固第Ⅷ 因子製剤原料)
、コ
ーンの低温エタノール分画工程から得られる PV(アルブミン製剤原料)
、PⅡ +Ⅲ (免疫
グロブリン製剤原料)
、PⅡ (免疫グロブリン製剤原料)
、そして PⅣ -1 (アンチトロンビ
ンⅢ 製剤原料)などの中間原料が挙げられる。
これらの中間原料を原料とし、血漿分画製剤を製造する場合においても、製剤の製造業者
が原料の受け入れ試験として適切なウイルス検査を実施する必要がある。ただし、中間原料
5
7
等による汚染の可能性を極力低減させるため、適切な製造環境、条件及び技術を採用しなけ
ればならない。
製造工程における原血漿以外からのウイルス汚染の可能性として以下のことが考えられ
る。
(1)製造従事者より汚染される。
(2)製造施設環境より汚染される。
(3)製造工程において用いる動物由来酵素やモノクローナル抗体等の原料等からウイルス
が混入する。
近年の技術進歩はめざましく、有用なウイルスの検査技術、ウイルスの除去技術及び不活
化技術については積極的に導入する必要がある。脂質膜を持つウイルスの除去・不活化につ
いては、可能な限り頑健性の高い 2 つ以上の原理が異なるウイルスクリアランス工程を導
入すること。脂質膜を持たないウイルスの除去・不活化については、頑健性の高いウイルス
クリアランス工程を少なくとも 1 工程導入するように努めること。また、製造工程にはウ
イルス安全性が確保された原料等を用いることにより、ウイルスの混入の可能性に対する
安全性を高める必要がある。
3.1
工程前検査
工程前検査の対象となるのは、一人の供血者の血液から製造された血漿、少人数の血漿を
プールしたミニプール血漿及びプール血漿である。一人の供血者の血液から製造された血
漿ではその特異性や感度、精度が十分に評価された試験法を用いて HBV、HCV 及び HIV
の血清学的検査を行うこと。ミニプール血漿及びプール血漿についても、その特異性、感度
及び精度が十分に評価された核酸増幅検査(Nucleic acid amplification test; NAT)を用い
て HBV、HCV 及び HIV の遺伝子検査を実施する。必要に応じて HBV、HCV、HIV 以外
のウイルスの試験の実施を考慮すること。既に採血時に個別 NAT 等による検査が行われて
いる場合にはその結果をもって工程前検査が実施されたものとみなすことができる。
3.2
中間血漿分画物(中間原料)の管理
血漿分画製剤を製造する際に使用する原料は必ずしも血漿とは限らず、中間原料製造業
者において製造された血漿由来の中間原料を、製剤の製造業者が原料として使用し、精製工
程を経て製品化することがある。例えば、クリオ沈殿物(血液凝固第Ⅷ 因子製剤原料)
、コ
ーンの低温エタノール分画工程から得られる PV(アルブミン製剤原料)
、PⅡ +Ⅲ (免疫
グロブリン製剤原料)
、PⅡ (免疫グロブリン製剤原料)
、そして PⅣ -1 (アンチトロンビ
ンⅢ 製剤原料)などの中間原料が挙げられる。
これらの中間原料を原料とし、血漿分画製剤を製造する場合においても、製剤の製造業者
が原料の受け入れ試験として適切なウイルス検査を実施する必要がある。ただし、中間原料
5
7