よむ、つかう、まなぶ。
参考資料 2 血漿分画製剤のウイルスに対する安全性確保に関するガイドラインの一部改正について(令和6年3月 29 日付け医薬発 0329 第 16 号厚生労働省医薬局長通知) (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40647.html |
| 出典情報 | 薬事審議会 血液事業部会運営委員会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
類のモデルウイルスを選択することが可能な場合には、原則としてウイルス除去及び不活
化処理に対してより抵抗性の強いウイルスを選択すること。
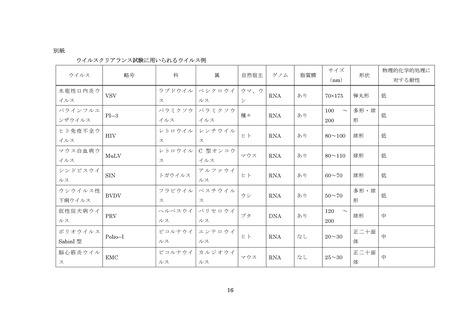
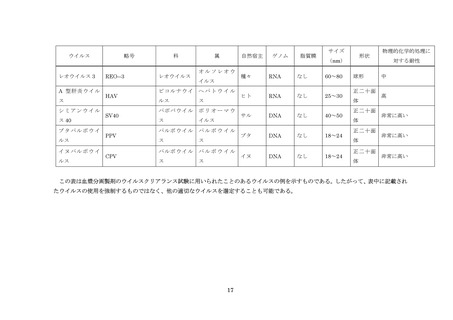
血漿分画製剤のウイルスクリアランス試験に用いられるウイルスの例については別紙を
参照すること。
4.3
ウイルスクリアランス試験の設計
ウイルスクリアランス試験は、対象となる特定の製造工程段階で意図的にウイルスを添
加し、当該製造工程のウイルスクリアランス能を定量的に評価するものである。したがって、
当該製剤の全ての製造工程を検証する必要はなく、ウイルスの除去及び不活化に寄与する
製造工程だけについて実施すること。
ウイルスクリアランス能の評価においては、製造者がその製造工程を適切に反映した実
験室規模で実施した結果に基づいて評価することを原則とする。いかなるウイルスも製造
施設に故意に持ち込むことはできないため、ウイルスクリアランス試験は、製造設備とは別
のウイルス試験設備で行わなければならない。このため、ウイルスクリアランス試験は、ウ
イルス学的研究を行う設備のある隔離されたウイルス試験設備において、ウイルス学の専
門家と生産技術者が共同で行う必要がある。この製造規模を縮小して行うウイルスクリア
ランス試験は、実生産規模での製造工程との同等性が検証されていることが前提でなけれ
ばならない。クロマトグラフィー工程については、カラムベッド高、線流速、ベッド容量に
対する流速の比率(すなわち接触時間)
、緩衝液、カラム充填剤の種類、pH、温度、タンパ
ク質濃度、塩濃度、製品濃度に関しても、全て実生産スケールの製造に対応している必要が
ある。また、溶出のプロフィールも同様のものが得られるように設計するべきである。同様
な考え方をその他の工程についても適用することが必要である。しかし、やむを得ない事情
により実際の製造工程を反映させることができない場合には、それが結果にどの様な影響
を及ぼすかを考察しておくべきである。
ウイルスクリアランス試験の計画を立案する際、検討することが望ましい留意点を以下
に示す。
(1)製造工程の設計にあたっては、ウイルスを除去又は不活化できる、機序の異なる 2 つ
以上の工程の採用について検討するように努めること。
(2)ウイルスを除去又は不活化することが予想される工程について、その能力を個々に評
価し、それぞれが除去工程なのか、不活化工程なのか、あるいは除去及び不活化のいず
れにも関与しているものかを明らかにできるような試験を計画すること。
(3)ウイルスクリアランス能に影響を及ぼす製造工程上の変動因子について検討すること。
(4)ウイルスに対する抗体が出発原料に存在する場合には、ウイルス除去工程及び不活化
工程におけるウイルスの挙動に影響を及ぼす可能性があるので、ウイルスクリアラン
ス試験ではこのことを考慮して実施する。また、原血漿の混合により抗体が特定のウイ
ルスの不活化に寄与することを評価する場合には、抗体の中和活性を適切に評価でき
7
9
化処理に対してより抵抗性の強いウイルスを選択すること。
血漿分画製剤のウイルスクリアランス試験に用いられるウイルスの例については別紙を
参照すること。
4.3
ウイルスクリアランス試験の設計
ウイルスクリアランス試験は、対象となる特定の製造工程段階で意図的にウイルスを添
加し、当該製造工程のウイルスクリアランス能を定量的に評価するものである。したがって、
当該製剤の全ての製造工程を検証する必要はなく、ウイルスの除去及び不活化に寄与する
製造工程だけについて実施すること。
ウイルスクリアランス能の評価においては、製造者がその製造工程を適切に反映した実
験室規模で実施した結果に基づいて評価することを原則とする。いかなるウイルスも製造
施設に故意に持ち込むことはできないため、ウイルスクリアランス試験は、製造設備とは別
のウイルス試験設備で行わなければならない。このため、ウイルスクリアランス試験は、ウ
イルス学的研究を行う設備のある隔離されたウイルス試験設備において、ウイルス学の専
門家と生産技術者が共同で行う必要がある。この製造規模を縮小して行うウイルスクリア
ランス試験は、実生産規模での製造工程との同等性が検証されていることが前提でなけれ
ばならない。クロマトグラフィー工程については、カラムベッド高、線流速、ベッド容量に
対する流速の比率(すなわち接触時間)
、緩衝液、カラム充填剤の種類、pH、温度、タンパ
ク質濃度、塩濃度、製品濃度に関しても、全て実生産スケールの製造に対応している必要が
ある。また、溶出のプロフィールも同様のものが得られるように設計するべきである。同様
な考え方をその他の工程についても適用することが必要である。しかし、やむを得ない事情
により実際の製造工程を反映させることができない場合には、それが結果にどの様な影響
を及ぼすかを考察しておくべきである。
ウイルスクリアランス試験の計画を立案する際、検討することが望ましい留意点を以下
に示す。
(1)製造工程の設計にあたっては、ウイルスを除去又は不活化できる、機序の異なる 2 つ
以上の工程の採用について検討するように努めること。
(2)ウイルスを除去又は不活化することが予想される工程について、その能力を個々に評
価し、それぞれが除去工程なのか、不活化工程なのか、あるいは除去及び不活化のいず
れにも関与しているものかを明らかにできるような試験を計画すること。
(3)ウイルスクリアランス能に影響を及ぼす製造工程上の変動因子について検討すること。
(4)ウイルスに対する抗体が出発原料に存在する場合には、ウイルス除去工程及び不活化
工程におけるウイルスの挙動に影響を及ぼす可能性があるので、ウイルスクリアラン
ス試験ではこのことを考慮して実施する。また、原血漿の混合により抗体が特定のウイ
ルスの不活化に寄与することを評価する場合には、抗体の中和活性を適切に評価でき
7
9