よむ、つかう、まなぶ。
参考資料 2 血漿分画製剤のウイルスに対する安全性確保に関するガイドラインの一部改正について(令和6年3月 29 日付け医薬発 0329 第 16 号厚生労働省医薬局長通知) (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40647.html |
| 出典情報 | 薬事審議会 血液事業部会運営委員会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1
序論
1.1
目的
本ガイドラインは、血漿分画製剤のウイルスに対する現時点での総合的な安全確保対策
についての原則的な考え方を示すものである。具体的には、血漿分画製剤の製造工程でのウ
イルス除去及び不活化能(以下「ウイルスクリアランス能」という。
)を評価するために実
施するウイルスクリアランス試験に関して、使用するウイルスの種類、試験の立案、実施、
データの解釈、製品の安全性の指標について提示するものであり、また、混入するリスクの
あるウイルスに係る試験のタイミング及び試験法についての考え方を示すものである。本
ガイドラインは、血漿分画製剤の製造上の一連のウイルス安全対策を全て網羅している。し
たがって、本ガイドラインに沿った、献(供)血者の選択、個別血液のウイルス検査、プー
ル血漿のウイルス検査、製造工程でのウイルス除去及び不活化処理、製造工程でのウイルス
検査、並びに採血後情報及び輸血後情報等の遡及調査を適切に行うことにより、血漿分画製
剤の安全性の向上を図ることが可能である。
1.2
対象
本ガイドラインは国内で使用される全ての原血漿、中間原料、及び製品に適用し、安全性
確保対策の対象とするウイルスは、
「生物由来原料基準」
(平成 15 年厚生労働省告示第 210
号)の「第2 血液製剤総則」の「2 血漿分画製剤総則」において検査対象とされている
B 型肝炎ウイルス(HBV)
、C 型肝炎ウイルス(HCV)及びヒト免疫不全ウイルス(HIV)
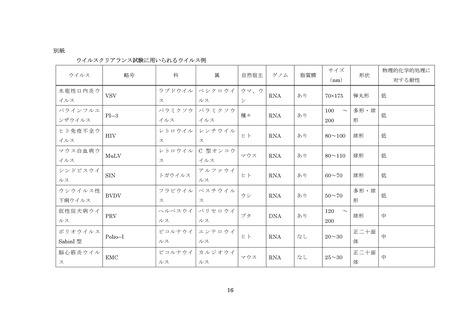
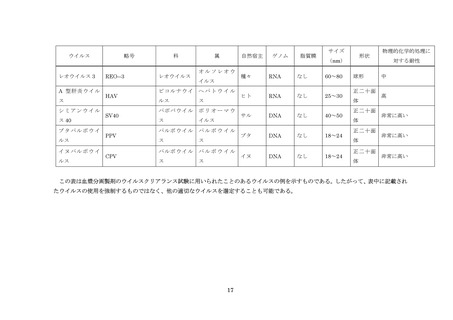
に加え、健康被害をもたらす可能性が指摘され血液に混入リスクのあるその他のウイルス
も含むものとする。
1.3
感染性因子
血漿分画製剤はヒトの血液を原料として製造されることから、血液を介して伝播するウ
イルスに対する十分な対策を講じなければならない。現在、HBV、HCV 及び HIV 等に係
る高い感度のスクリーニング検査や製造工程でのウイルス除去及び不活化処理が実施され
ており、血漿分画製剤の安全性は格段に向上している。一方、血液を介したウイルス感染の
歴史的経過を顧みると、ウイルス肝炎についての報告や 1980 年代の血漿分画製剤による
HIV や HCV 感染があったことに加え、その後も国内外で複数の新興・再興感染症の発症が
報告されている。血漿分画製剤の安全性確保の上で問題になりうる主なウイルスとして、B
型肝炎ウイルス(HBV)
、C 型肝炎ウイルス(HCV)
、ヒト免疫不全ウイルス(HIV)のほ
か、A 型肝炎ウイルス(HAV)
、E 型肝炎ウイルス(HEV)
、ヒトパルボウイルス B19 など
が挙げられる。さらに血漿分画製剤は、多くのヒトの血漿をプールして製造されるため、検
査対象とされていないウイルスや未知のウイルスなどが潜在している可能性があり、安全
対策を徹底して実施する必要がある。例えば、新興感染症として新たなウイルスが出現した
場合、原料となる血液に混入するリスクが否定できない場合はウイルス検査の必要性につ
2
4
序論
1.1
目的
本ガイドラインは、血漿分画製剤のウイルスに対する現時点での総合的な安全確保対策
についての原則的な考え方を示すものである。具体的には、血漿分画製剤の製造工程でのウ
イルス除去及び不活化能(以下「ウイルスクリアランス能」という。
)を評価するために実
施するウイルスクリアランス試験に関して、使用するウイルスの種類、試験の立案、実施、
データの解釈、製品の安全性の指標について提示するものであり、また、混入するリスクの
あるウイルスに係る試験のタイミング及び試験法についての考え方を示すものである。本
ガイドラインは、血漿分画製剤の製造上の一連のウイルス安全対策を全て網羅している。し
たがって、本ガイドラインに沿った、献(供)血者の選択、個別血液のウイルス検査、プー
ル血漿のウイルス検査、製造工程でのウイルス除去及び不活化処理、製造工程でのウイルス
検査、並びに採血後情報及び輸血後情報等の遡及調査を適切に行うことにより、血漿分画製
剤の安全性の向上を図ることが可能である。
1.2
対象
本ガイドラインは国内で使用される全ての原血漿、中間原料、及び製品に適用し、安全性
確保対策の対象とするウイルスは、
「生物由来原料基準」
(平成 15 年厚生労働省告示第 210
号)の「第2 血液製剤総則」の「2 血漿分画製剤総則」において検査対象とされている
B 型肝炎ウイルス(HBV)
、C 型肝炎ウイルス(HCV)及びヒト免疫不全ウイルス(HIV)
に加え、健康被害をもたらす可能性が指摘され血液に混入リスクのあるその他のウイルス
も含むものとする。
1.3
感染性因子
血漿分画製剤はヒトの血液を原料として製造されることから、血液を介して伝播するウ
イルスに対する十分な対策を講じなければならない。現在、HBV、HCV 及び HIV 等に係
る高い感度のスクリーニング検査や製造工程でのウイルス除去及び不活化処理が実施され
ており、血漿分画製剤の安全性は格段に向上している。一方、血液を介したウイルス感染の
歴史的経過を顧みると、ウイルス肝炎についての報告や 1980 年代の血漿分画製剤による
HIV や HCV 感染があったことに加え、その後も国内外で複数の新興・再興感染症の発症が
報告されている。血漿分画製剤の安全性確保の上で問題になりうる主なウイルスとして、B
型肝炎ウイルス(HBV)
、C 型肝炎ウイルス(HCV)
、ヒト免疫不全ウイルス(HIV)のほ
か、A 型肝炎ウイルス(HAV)
、E 型肝炎ウイルス(HEV)
、ヒトパルボウイルス B19 など
が挙げられる。さらに血漿分画製剤は、多くのヒトの血漿をプールして製造されるため、検
査対象とされていないウイルスや未知のウイルスなどが潜在している可能性があり、安全
対策を徹底して実施する必要がある。例えば、新興感染症として新たなウイルスが出現した
場合、原料となる血液に混入するリスクが否定できない場合はウイルス検査の必要性につ
2
4