よむ、つかう、まなぶ。
参考資料 2 血漿分画製剤のウイルスに対する安全性確保に関するガイドラインの一部改正について(令和6年3月 29 日付け医薬発 0329 第 16 号厚生労働省医薬局長通知) (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40647.html |
| 出典情報 | 薬事審議会 血液事業部会運営委員会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
めること。また、製造工程にはウイルス安全性が確保された原料等を用いることにより、ウイルスの混入
の可能性に対する安全性を高める必要がある。
3.1 工程前検査
3.1 工程前検査
工程前検査の対象となるのは、一人の供血者の血液から製造された血漿、少人数の血漿をプールしたミ
出発原料には一人の供血者の血液から製造された血漿、少人数の血漿をプールしたミニプール血漿及び
ニプール血漿及びプール血漿である。一人の供血者の血液から製造された血漿ではその特異性や感度、精 原料プール血漿がある。一人の供血者の血液から製造された血漿ではその特異性や感度、精度が十分に評
度が十分に評価された試験法を用いて HBV、HCV 及び HIV の血清学的検査を行うこと。ミニプール血漿及 価された試験法を用いて HCV、HBV 及び HIV の血清学的検査を行う。ミニプール血漿及び原料プール血漿
びプール血漿についても、その特異性、感度及び精度が十分に評価された核酸増幅検査(Nucleic acid についても、その特異性、感度及び精度が十分に評価された核酸増幅法検査(NAT)を用いて HCV、HBV 及び
amplification test; NAT)を用いて HBV、HCV 及び HIV の遺伝子検査を実施する。必要に応じて HBV、HCV、 HIV の遺伝子検査を実施する。
HIV 以外のウイルスの試験の実施を考慮すること。既に採血時に個別 NAT 等による検査が行われている場
合にはその結果をもって工程前検査が実施されたものとみなすことができる。
3
4
製造及び検査
ウイルスクリア
ランス試験
3.2 中間血漿分画物(中間原料)の管理
血漿分画製剤を製造する際に使用する原料は必ずしも血漿とは限らず、中間原料製造業者において製造
された血漿由来の中間原料を、製剤の製造業者が原料として使用し、精製工程を経て製品化することがあ
る。例えば、クリオ沈殿物(血液凝固第Ⅷ因子製剤原料)、コーンの低温エタノール分画工程から得られる
PⅤ(アルブミン製剤原料)
、PⅡ+Ⅲ(免疫グロブリン製剤原料)
、PⅡ(免疫グロブリン製剤原料)
、そし
て PⅣ-1(アンチトロンビンⅢ製剤原料)などの中間原料が挙げられる。
これらの中間原料を原料とし、血漿分画製剤を製造する場合においても、製剤の製造業者が原料の受け
入れ試験として適切なウイルス検査を実施する必要がある。ただし、中間原料製造業者により、既に適切
なウイルス検査が実施されており、その詳細を確認できる場合はその限りではない。
なお、当該中間原料については、中間原料製造業者により、既に適切なウイルス検査が行われている必
要がある。また、中間原料の製造においてウイルスの除去及び不活化工程がある場合には、製剤の製造業
者がそのデータを入手しウイルスクリアランス能などウイルスに対する安全性を説明できるようにしな
ければならない。
3.2 中間血漿分画物(中間原料)の工程前検査
血漿分画製剤を製造する際に使用する原料は必ずしも血漿とは限らず、血漿由来の中間原料を原料とし
て使用し、精製工程を経て製品化することがある。例えば、クリオ沈殿物(血液凝固第Ⅷ因子製剤原料)、
コーンの低温エタノール分画工程から得られる PⅤ(アルブミン製剤原料)、PⅡ+Ⅲ(免疫グロブリン製剤
原料)、PⅡ(免疫グロブリン製剤原料)、そして PⅣ―1(アンチトロンビンⅢ製剤原料)などの中間原料が挙
げられる。
これらの中間原料を原料とし、血漿分画製剤を製造する場合においても受け入れ試験として適切なウイ
ルス検査を実施する必要がある。
なお、当該中間原料については、中間原料製造業者により、既に本ガイドラインに沿った試験が行われ
ている必要がある。
3.3 製造工程でのウイルス検査
出発原料に対する各種ウイルス検査の実施、製造工程におけるウイルス除去及び不活化を的確に実施す
るとともに、必要に応じて製造工程での適切なウイルス検査を行うこと。
3.3 最終製品の検査
出発原料の各種ウイルス検査の実施、製造工程におけるウイルス除去及び不活化工程を的確に実施する
とともに最終製品のウイルス検査を行う。
4 ウイルスクリアランス試験
4.1 ウイルスクリアランス試験の目的
ウイルスクリアランス試験の目的は、原血漿に存在する可能性のある既知のウイルス及び未知のウイル
スを、製造工程で効果的に除去及び不活化できることを検証又は推測することにある。
これは、原血漿又は工程途中の材料に意図的にウイルスを添加し、それぞれの製造工程の除去又は不活
化の効果を評価することにより達成される。この試験により、ウイルスの有効な除去工程又は不活化工程
が特定され、それぞれの工程のウイルスクリアランス能を加算することにより製造工程全体におけるウイ
ルスクリアランス能の推定値が得られる。
ウイルスクリアランス試験の実施により、製剤のウイルスに関する安全性についての信頼性を高めるこ
とができる。しかし、この試験には多くの複雑な変動因子が関与しているため、試験方法や得られたウイ
ルスクリアランス能の評価の妥当性については個別に検討する必要がある。
4 ウイルス・プロセスバリデーション
4.1 ウイルス・プロセスバリデーションの目的
ウイルス・プロセスバリデーションの目的は、原料血漿に存在する可能性のある既知のウイルス及び未
知のウイルスを、製造工程で効果的に除去及び不活化できることを検証又は推測することにある。
これは、原料血漿又は工程途中の材料に意図的にウイルスを添加し、全製造工程の除去及び不活化の効
果を評価することにより達成される。この試験により、ウイルスの有効な除去又は不活化工程が特定され、
全製造工程におけるウイルスの除去及び不活化能力の推定値が得られる。
ウイルスバリデーション試験の実施により、製剤のウイルスに関する安全性についての信頼性を高める
ことができる。しかし、この試験には多くの複雑な変動因子が関与しているので、内容が適切か否かにつ
いては個別に検討する必要がある。
4.2 ウイルスの選択
4.2 ウイルスの選択
広範なウイルスに対するクリアランス能を評価するためのウイルスクリアランス工程特性解析試験に
バリデーション試験に使用されるモデルウイルスとしては、広範囲にウイルス除去及び不活化の情報を
使用される非特異的モデルウイルスは、広範囲なウイルスクリアランス能の情報を得るという観点から選 得るという観点から、DNA ウイルス及び RNA ウイルス、エンベロープの有無、粒子径の大小を考慮し、さ
択されるべきである。そのため、DNA ウイルス及び RNA ウイルス、脂質膜の有無、粒子径の大小を考慮し、 らに物理的処理及び化学的処理に対する抵抗性が高いものを選択することが望ましい。これらの特性を網
さらに物理的処理及び化学的処理に対する抵抗性が高いものを選択することが望ましい。これらの特性を 羅するには 3 種類程度のモデルウイルスを組み合わせることが必要になる。
網羅するには少なくとも 4 種類以上の非特異的モデルウイルスを組み合わせることが必要になる。
原料血漿に存在している可能性のあるウイルスに類似している、あるいは同じ特性を持っているなどの
一方、原血漿に存在しているかあるいは存在が予測される特定のウイルスに対するウイルスクリアラン 理由で 2 種類のモデルウイルスを選択することが可能な場合には、原則的にウイルス除去及び不活化処理
ス工程評価試験では、関連ウイルスないしは関連ウイルスに類似した特性を持つ特異的モデルウイルスを に対してより抵抗性の強いウイルスを選択する。
用いた評価を実施することになる。原血漿に混在している可能性のあるウイルスに類似している、あるい
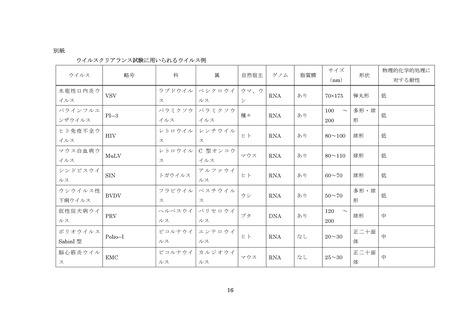
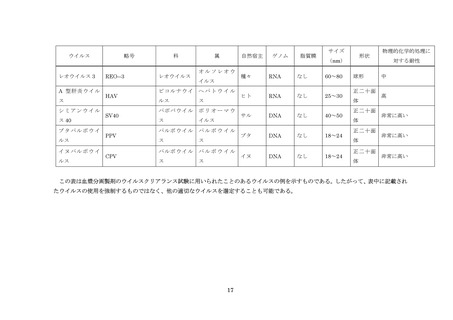
血漿分画製剤のウイルス・プロセスバリデーション試験に用いられるウイルスの例については別紙参
4
23
の可能性に対する安全性を高める必要がある。
3.1 工程前検査
3.1 工程前検査
工程前検査の対象となるのは、一人の供血者の血液から製造された血漿、少人数の血漿をプールしたミ
出発原料には一人の供血者の血液から製造された血漿、少人数の血漿をプールしたミニプール血漿及び
ニプール血漿及びプール血漿である。一人の供血者の血液から製造された血漿ではその特異性や感度、精 原料プール血漿がある。一人の供血者の血液から製造された血漿ではその特異性や感度、精度が十分に評
度が十分に評価された試験法を用いて HBV、HCV 及び HIV の血清学的検査を行うこと。ミニプール血漿及 価された試験法を用いて HCV、HBV 及び HIV の血清学的検査を行う。ミニプール血漿及び原料プール血漿
びプール血漿についても、その特異性、感度及び精度が十分に評価された核酸増幅検査(Nucleic acid についても、その特異性、感度及び精度が十分に評価された核酸増幅法検査(NAT)を用いて HCV、HBV 及び
amplification test; NAT)を用いて HBV、HCV 及び HIV の遺伝子検査を実施する。必要に応じて HBV、HCV、 HIV の遺伝子検査を実施する。
HIV 以外のウイルスの試験の実施を考慮すること。既に採血時に個別 NAT 等による検査が行われている場
合にはその結果をもって工程前検査が実施されたものとみなすことができる。
3
4
製造及び検査
ウイルスクリア
ランス試験
3.2 中間血漿分画物(中間原料)の管理
血漿分画製剤を製造する際に使用する原料は必ずしも血漿とは限らず、中間原料製造業者において製造
された血漿由来の中間原料を、製剤の製造業者が原料として使用し、精製工程を経て製品化することがあ
る。例えば、クリオ沈殿物(血液凝固第Ⅷ因子製剤原料)、コーンの低温エタノール分画工程から得られる
PⅤ(アルブミン製剤原料)
、PⅡ+Ⅲ(免疫グロブリン製剤原料)
、PⅡ(免疫グロブリン製剤原料)
、そし
て PⅣ-1(アンチトロンビンⅢ製剤原料)などの中間原料が挙げられる。
これらの中間原料を原料とし、血漿分画製剤を製造する場合においても、製剤の製造業者が原料の受け
入れ試験として適切なウイルス検査を実施する必要がある。ただし、中間原料製造業者により、既に適切
なウイルス検査が実施されており、その詳細を確認できる場合はその限りではない。
なお、当該中間原料については、中間原料製造業者により、既に適切なウイルス検査が行われている必
要がある。また、中間原料の製造においてウイルスの除去及び不活化工程がある場合には、製剤の製造業
者がそのデータを入手しウイルスクリアランス能などウイルスに対する安全性を説明できるようにしな
ければならない。
3.2 中間血漿分画物(中間原料)の工程前検査
血漿分画製剤を製造する際に使用する原料は必ずしも血漿とは限らず、血漿由来の中間原料を原料とし
て使用し、精製工程を経て製品化することがある。例えば、クリオ沈殿物(血液凝固第Ⅷ因子製剤原料)、
コーンの低温エタノール分画工程から得られる PⅤ(アルブミン製剤原料)、PⅡ+Ⅲ(免疫グロブリン製剤
原料)、PⅡ(免疫グロブリン製剤原料)、そして PⅣ―1(アンチトロンビンⅢ製剤原料)などの中間原料が挙
げられる。
これらの中間原料を原料とし、血漿分画製剤を製造する場合においても受け入れ試験として適切なウイ
ルス検査を実施する必要がある。
なお、当該中間原料については、中間原料製造業者により、既に本ガイドラインに沿った試験が行われ
ている必要がある。
3.3 製造工程でのウイルス検査
出発原料に対する各種ウイルス検査の実施、製造工程におけるウイルス除去及び不活化を的確に実施す
るとともに、必要に応じて製造工程での適切なウイルス検査を行うこと。
3.3 最終製品の検査
出発原料の各種ウイルス検査の実施、製造工程におけるウイルス除去及び不活化工程を的確に実施する
とともに最終製品のウイルス検査を行う。
4 ウイルスクリアランス試験
4.1 ウイルスクリアランス試験の目的
ウイルスクリアランス試験の目的は、原血漿に存在する可能性のある既知のウイルス及び未知のウイル
スを、製造工程で効果的に除去及び不活化できることを検証又は推測することにある。
これは、原血漿又は工程途中の材料に意図的にウイルスを添加し、それぞれの製造工程の除去又は不活
化の効果を評価することにより達成される。この試験により、ウイルスの有効な除去工程又は不活化工程
が特定され、それぞれの工程のウイルスクリアランス能を加算することにより製造工程全体におけるウイ
ルスクリアランス能の推定値が得られる。
ウイルスクリアランス試験の実施により、製剤のウイルスに関する安全性についての信頼性を高めるこ
とができる。しかし、この試験には多くの複雑な変動因子が関与しているため、試験方法や得られたウイ
ルスクリアランス能の評価の妥当性については個別に検討する必要がある。
4 ウイルス・プロセスバリデーション
4.1 ウイルス・プロセスバリデーションの目的
ウイルス・プロセスバリデーションの目的は、原料血漿に存在する可能性のある既知のウイルス及び未
知のウイルスを、製造工程で効果的に除去及び不活化できることを検証又は推測することにある。
これは、原料血漿又は工程途中の材料に意図的にウイルスを添加し、全製造工程の除去及び不活化の効
果を評価することにより達成される。この試験により、ウイルスの有効な除去又は不活化工程が特定され、
全製造工程におけるウイルスの除去及び不活化能力の推定値が得られる。
ウイルスバリデーション試験の実施により、製剤のウイルスに関する安全性についての信頼性を高める
ことができる。しかし、この試験には多くの複雑な変動因子が関与しているので、内容が適切か否かにつ
いては個別に検討する必要がある。
4.2 ウイルスの選択
4.2 ウイルスの選択
広範なウイルスに対するクリアランス能を評価するためのウイルスクリアランス工程特性解析試験に
バリデーション試験に使用されるモデルウイルスとしては、広範囲にウイルス除去及び不活化の情報を
使用される非特異的モデルウイルスは、広範囲なウイルスクリアランス能の情報を得るという観点から選 得るという観点から、DNA ウイルス及び RNA ウイルス、エンベロープの有無、粒子径の大小を考慮し、さ
択されるべきである。そのため、DNA ウイルス及び RNA ウイルス、脂質膜の有無、粒子径の大小を考慮し、 らに物理的処理及び化学的処理に対する抵抗性が高いものを選択することが望ましい。これらの特性を網
さらに物理的処理及び化学的処理に対する抵抗性が高いものを選択することが望ましい。これらの特性を 羅するには 3 種類程度のモデルウイルスを組み合わせることが必要になる。
網羅するには少なくとも 4 種類以上の非特異的モデルウイルスを組み合わせることが必要になる。
原料血漿に存在している可能性のあるウイルスに類似している、あるいは同じ特性を持っているなどの
一方、原血漿に存在しているかあるいは存在が予測される特定のウイルスに対するウイルスクリアラン 理由で 2 種類のモデルウイルスを選択することが可能な場合には、原則的にウイルス除去及び不活化処理
ス工程評価試験では、関連ウイルスないしは関連ウイルスに類似した特性を持つ特異的モデルウイルスを に対してより抵抗性の強いウイルスを選択する。
用いた評価を実施することになる。原血漿に混在している可能性のあるウイルスに類似している、あるい
血漿分画製剤のウイルス・プロセスバリデーション試験に用いられるウイルスの例については別紙参
4
23