よむ、つかう、まなぶ。
参考資料 2 血漿分画製剤のウイルスに対する安全性確保に関するガイドラインの一部改正について(令和6年3月 29 日付け医薬発 0329 第 16 号厚生労働省医薬局長通知) (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40647.html |
| 出典情報 | 薬事審議会 血液事業部会運営委員会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
5
ウイルスクリア
ランスの再評価が必
要な場合
6
ウイルスクリア
ランス試験に用いる
測定法
7
記録と保存
8
その他
影響しないかを評価し、必要に応じてウイルスクリアランス試験を実施し、製造工程全体が適切なウイル
スクリアランス指数を有することを再度検証する。なお、製造工程の変更によってウイルスクリアランス
指数が変化する可能性があるため留意すること。
直接又は間接に影響しないかを考慮し、必要に応じてシステムを再度検証する必要がある。また、精製工
程を変更する場合にはウイルスクリアランスの程度を変える可能性がある。
6 ウイルスクリアランス試験に用いる測定法
6.1 ウイルス感染価の測定法
感染価の測定法には、プラーク測定法、細胞変性効果による検出法(例えば TCID50 法)などがある。測
定法は、十分な感度と再現性を持つべきであり、コントロールを用いて統計学的に分析可能な結果が得ら
れるようにすること。
6 ウイルス・プロセスバリデーションに係る測定法
6.1 ウイルス感染価の測定法
感染価の測定法には、プラーク測定法、細胞変性効果による検出法(例えば TCID50 法)などがある。測
定法は、十分な感度と再現性を持つべきであり、コントロールを用いて統計学的に分析可能な結果が得ら
れるようにする。
6.2 核酸増幅検査(NAT)
核酸増幅検査(Nucleic acid amplification test; NAT)は、現行の血清学的検査が陰性である時など
においてもウイルスゲノムを高感度に検出できる方法である。また、ウインドウ期の大幅な短縮が可能と
なり、血漿分画製剤の原料となるプール血漿のウイルス感染リスクを大幅に低減し、血漿分画製剤のウイ
ルスに対する安全性の向上に寄与するものと考えられる。
核酸増幅検査(NAT)は、ウイルスクリアランス試験において、ウイルス除去工程の有効な評価法となり
うる。しかしながら、ウイルス不活化工程では、不活化されたウイルスが依然としてウイルスゲノム陽性
の結果を示すことがあるため、ウイルス不活化の程度が過小評価される可能性がある。また、NAT を導入
する場合には、検出感度の妥当性、コントロールとして用いる標準品の選定、プライマー等、用いる試薬
の品質の維持及び陽性又は陰性結果の評価において十分な注意を払わなければならない。
現在、NAT を利用した定量的な解析法が開発されてきており、ウイルス標準品の単位設定にも用いられ
ている。定量的 NAT をウイルスクリアランス能の評価に用いる際には、ウイルス粒子の除去などが適切に
反映された試験法であることを確認し、試験の妥当性を説明する必要がある。NAT については、
「血液製剤
のウイルスに対する安全性確保を目的とした核酸増幅検査(NAT)の実施に関するガイドラインについて」
(平成 16 年8月3日付け薬食発第 0803002 号厚生労働省医薬食品局長通知)も参考にすること。
6.2 統計
ウイルスクリアランス試験における結果の評価に当たってはデータを統計学的手法を用いて解析する
必要がある。また、得られた結論については、試験結果の妥当性を統計学的に検証しなければならない。
6.3 統計
ウイルスクリアランス工程特性解析試験におけるウイルス感染価やウイルスクリアランス指数等の算
出には統計学的手法を用いる必要がある。ウイルスクリアランス工程評価試験については、必ずしも統計
学的手法を用いた解析を求めるものではない。また、ウイルスクリアランス工程特性解析試験で得られた
データでウイルス安全性が十分説明可能な場合には、新たにウイルスクリアランス工程評価試験を実施す
る必要がない。また、得られた結論については、試験結果の妥当性を評価しなければならない。
7
記録と保存
ウイルスクリアランス試験に係る項目については全て文書化し、保存しなければならない。
8
その他
8 その他
ウイルスクリアランス試験について ICH ガイドラインが適切に適用できる場合にはこれを参考にする。
ウイルスプロセスバリデーションについて ICH ガイドラインが適切に適用できる場合にはこれを参考に
する。
用語
用語
6.3 核酸増幅法検査
核酸増幅法(Nucleic acid amplification technology;NAT)検査は、現行の血清学的検査が陰性である
時でもウイルスゲノムを高感度に検出できる方法であり、血漿分画製剤の原料となる個々の血漿やプール
血漿を測定することにより、培養系で測定できない HBV や HCV 遺伝子などの検出に応用できる。また、
HBV、HCV 及び HIV に関しては、ウインドウピリオドの大幅な短縮が可能となり、血漿分画製剤の原料とな
るプール血漿へのウイルス混入量を低減し、血漿分画製剤のウイルスに対する安全性の向上に寄与するも
のと考えられる。
核酸増幅法(NAT)検査は、ウイルス・プロセスバリデーションにおいて、ウイルス除去工程の有効な評価
法となりうる。しかしながら、ウイルス不活化工程では、不活化されたウイルスが依然として核酸陽性の
結果を示すことがあるため、ウイルス不活化の程度が過小評価される可能性がある。また、核酸増幅法
(NAT)検査を導入する場合には、検出感度の妥当性、コントロールとして用いる標準品の選定、プライマー
等、用いる試薬の品質の維持及び陽性又は陰性結果の評価において十分な注意を払わなければならない。
現在、核酸増幅法(NAT)検査には標準的な方法が確立されておらず、各施設ごとに異なった方法で実施
されている。標準化された核酸増幅法(NAT)検査を導入するにあたっては、適切な試薬、標準品等を用いた
特異性、検出感度、再現性精度の同等性などを検証するために施設間での共同研究を行い、将来的には国
内の全施設において共通の水準で実施できるような核酸増幅法(NAT)検査の開発に資することが期待され
る。
7
記録と保存
ウイルス・プロセスバリデーションに係る項目についてはすべて文書化し、保存しなければならない。
用語
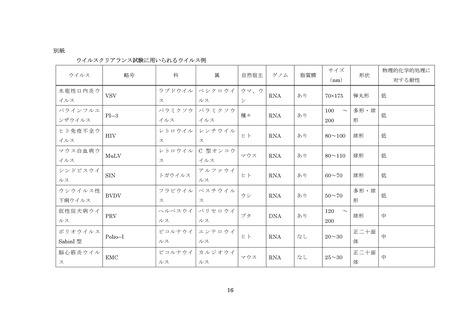
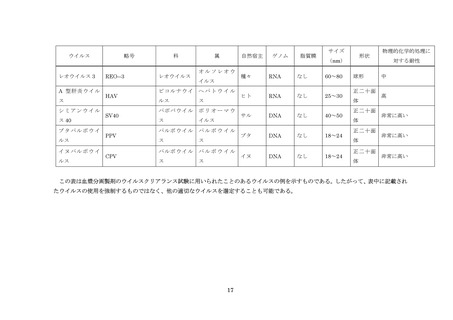
非特異的モデルウイルス
製造工程がウイルス除去及び不活化に関して一般にどの程度の能力を有するかを解析する目的、すなわ
ち工程が確実にウイルスクリアランス能を発揮するという面での特性を解析する目的で行うウイルスク
リアランス工程特性解析試験に使用されるウイルス。
モデルウイルス
製造工程がウイルスの除去や不活化に関して一般にどの程度の能力を有するかを解析する目的,すなわ
ち工程が確実にウイルスクリアランス能力を発揮するという面での特性を解析する目的で行うウイルス
クリアランス工程特性解析試験に使用されるウイルス。
関連ウイルス
製造原料に混在することが知られているか、あるいは存在の可能性があるウイルス類と同一又は同種の
ウイルスで、ウイルスクリアランス工程評価試験に用いられるもの。
8
27
ウイルスクリア
ランスの再評価が必
要な場合
6
ウイルスクリア
ランス試験に用いる
測定法
7
記録と保存
8
その他
影響しないかを評価し、必要に応じてウイルスクリアランス試験を実施し、製造工程全体が適切なウイル
スクリアランス指数を有することを再度検証する。なお、製造工程の変更によってウイルスクリアランス
指数が変化する可能性があるため留意すること。
直接又は間接に影響しないかを考慮し、必要に応じてシステムを再度検証する必要がある。また、精製工
程を変更する場合にはウイルスクリアランスの程度を変える可能性がある。
6 ウイルスクリアランス試験に用いる測定法
6.1 ウイルス感染価の測定法
感染価の測定法には、プラーク測定法、細胞変性効果による検出法(例えば TCID50 法)などがある。測
定法は、十分な感度と再現性を持つべきであり、コントロールを用いて統計学的に分析可能な結果が得ら
れるようにすること。
6 ウイルス・プロセスバリデーションに係る測定法
6.1 ウイルス感染価の測定法
感染価の測定法には、プラーク測定法、細胞変性効果による検出法(例えば TCID50 法)などがある。測
定法は、十分な感度と再現性を持つべきであり、コントロールを用いて統計学的に分析可能な結果が得ら
れるようにする。
6.2 核酸増幅検査(NAT)
核酸増幅検査(Nucleic acid amplification test; NAT)は、現行の血清学的検査が陰性である時など
においてもウイルスゲノムを高感度に検出できる方法である。また、ウインドウ期の大幅な短縮が可能と
なり、血漿分画製剤の原料となるプール血漿のウイルス感染リスクを大幅に低減し、血漿分画製剤のウイ
ルスに対する安全性の向上に寄与するものと考えられる。
核酸増幅検査(NAT)は、ウイルスクリアランス試験において、ウイルス除去工程の有効な評価法となり
うる。しかしながら、ウイルス不活化工程では、不活化されたウイルスが依然としてウイルスゲノム陽性
の結果を示すことがあるため、ウイルス不活化の程度が過小評価される可能性がある。また、NAT を導入
する場合には、検出感度の妥当性、コントロールとして用いる標準品の選定、プライマー等、用いる試薬
の品質の維持及び陽性又は陰性結果の評価において十分な注意を払わなければならない。
現在、NAT を利用した定量的な解析法が開発されてきており、ウイルス標準品の単位設定にも用いられ
ている。定量的 NAT をウイルスクリアランス能の評価に用いる際には、ウイルス粒子の除去などが適切に
反映された試験法であることを確認し、試験の妥当性を説明する必要がある。NAT については、
「血液製剤
のウイルスに対する安全性確保を目的とした核酸増幅検査(NAT)の実施に関するガイドラインについて」
(平成 16 年8月3日付け薬食発第 0803002 号厚生労働省医薬食品局長通知)も参考にすること。
6.2 統計
ウイルスクリアランス試験における結果の評価に当たってはデータを統計学的手法を用いて解析する
必要がある。また、得られた結論については、試験結果の妥当性を統計学的に検証しなければならない。
6.3 統計
ウイルスクリアランス工程特性解析試験におけるウイルス感染価やウイルスクリアランス指数等の算
出には統計学的手法を用いる必要がある。ウイルスクリアランス工程評価試験については、必ずしも統計
学的手法を用いた解析を求めるものではない。また、ウイルスクリアランス工程特性解析試験で得られた
データでウイルス安全性が十分説明可能な場合には、新たにウイルスクリアランス工程評価試験を実施す
る必要がない。また、得られた結論については、試験結果の妥当性を評価しなければならない。
7
記録と保存
ウイルスクリアランス試験に係る項目については全て文書化し、保存しなければならない。
8
その他
8 その他
ウイルスクリアランス試験について ICH ガイドラインが適切に適用できる場合にはこれを参考にする。
ウイルスプロセスバリデーションについて ICH ガイドラインが適切に適用できる場合にはこれを参考に
する。
用語
用語
6.3 核酸増幅法検査
核酸増幅法(Nucleic acid amplification technology;NAT)検査は、現行の血清学的検査が陰性である
時でもウイルスゲノムを高感度に検出できる方法であり、血漿分画製剤の原料となる個々の血漿やプール
血漿を測定することにより、培養系で測定できない HBV や HCV 遺伝子などの検出に応用できる。また、
HBV、HCV 及び HIV に関しては、ウインドウピリオドの大幅な短縮が可能となり、血漿分画製剤の原料とな
るプール血漿へのウイルス混入量を低減し、血漿分画製剤のウイルスに対する安全性の向上に寄与するも
のと考えられる。
核酸増幅法(NAT)検査は、ウイルス・プロセスバリデーションにおいて、ウイルス除去工程の有効な評価
法となりうる。しかしながら、ウイルス不活化工程では、不活化されたウイルスが依然として核酸陽性の
結果を示すことがあるため、ウイルス不活化の程度が過小評価される可能性がある。また、核酸増幅法
(NAT)検査を導入する場合には、検出感度の妥当性、コントロールとして用いる標準品の選定、プライマー
等、用いる試薬の品質の維持及び陽性又は陰性結果の評価において十分な注意を払わなければならない。
現在、核酸増幅法(NAT)検査には標準的な方法が確立されておらず、各施設ごとに異なった方法で実施
されている。標準化された核酸増幅法(NAT)検査を導入するにあたっては、適切な試薬、標準品等を用いた
特異性、検出感度、再現性精度の同等性などを検証するために施設間での共同研究を行い、将来的には国
内の全施設において共通の水準で実施できるような核酸増幅法(NAT)検査の開発に資することが期待され
る。
7
記録と保存
ウイルス・プロセスバリデーションに係る項目についてはすべて文書化し、保存しなければならない。
用語
非特異的モデルウイルス
製造工程がウイルス除去及び不活化に関して一般にどの程度の能力を有するかを解析する目的、すなわ
ち工程が確実にウイルスクリアランス能を発揮するという面での特性を解析する目的で行うウイルスク
リアランス工程特性解析試験に使用されるウイルス。
モデルウイルス
製造工程がウイルスの除去や不活化に関して一般にどの程度の能力を有するかを解析する目的,すなわ
ち工程が確実にウイルスクリアランス能力を発揮するという面での特性を解析する目的で行うウイルス
クリアランス工程特性解析試験に使用されるウイルス。
関連ウイルス
製造原料に混在することが知られているか、あるいは存在の可能性があるウイルス類と同一又は同種の
ウイルスで、ウイルスクリアランス工程評価試験に用いられるもの。
8
27