よむ、つかう、まなぶ。
薬ー1参考1 (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41478.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第225回 7/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ラセミ体又は先行品が存在する新薬の特例
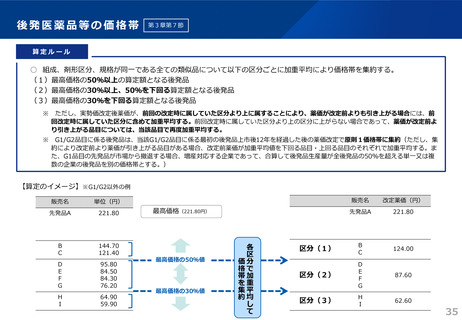
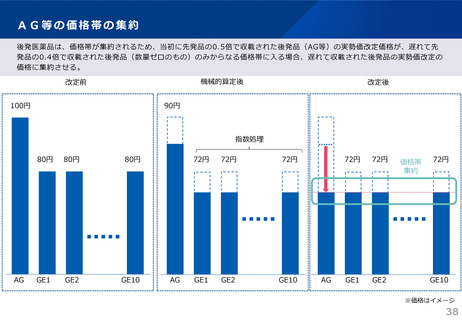
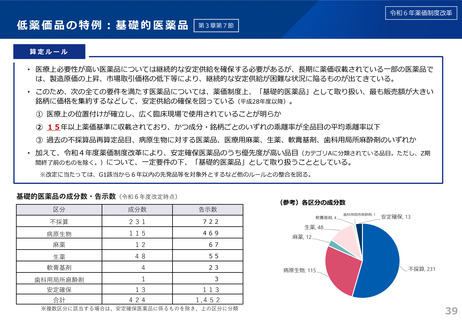
算定ルール
(1)特例の対象となる新薬
次のいずれかの要件に該当するもの。
イ 光学分割した成分を新有効成分とする新薬であって当該成分を含むラセミ体の既収載品と投与経路、効能及び効果等に大
きな違いがないもの。ただし、光学分割を行ったことにより当該ラセミ体に比し高い有効性又は安全性を有することが客観
的に示されている場合を除く。
ロ 製造販売業者、主たる効能及び効果、薬理作用、投与形態並びに臨床上の位置付けが同一、又は同一とみなせる既収載品
(以下「先行品」という。)があり、当該先行品の薬価収載の日から5年を経過した後に薬価収載されるもの。ただし、補
正加算に該当する場合又は開発の経緯や臨床試験等から臨床的意義が認められる場合を除く。
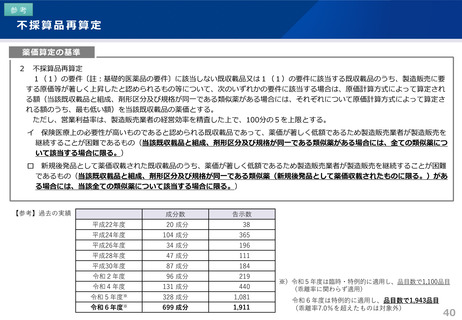
(2)ラセミ体又は先行品が存在する新薬の特例
当該ラセミ体の既収載品又は当該先行品を比較薬とした類似薬効比較方式(Ⅰ)によって算定される額に100分の80を乗じて
得た額(補正加算の対象となる場合には当該額に補正加算を行った額)を当該新薬の薬価とする。ただし、類似薬効比較方式
(Ⅱ)の要件にも該当し、当該算定額がより低い場合は、類似薬効比較方式(Ⅱ)によって算定される額を当該新薬の薬価と
する。
17
算定ルール
(1)特例の対象となる新薬
次のいずれかの要件に該当するもの。
イ 光学分割した成分を新有効成分とする新薬であって当該成分を含むラセミ体の既収載品と投与経路、効能及び効果等に大
きな違いがないもの。ただし、光学分割を行ったことにより当該ラセミ体に比し高い有効性又は安全性を有することが客観
的に示されている場合を除く。
ロ 製造販売業者、主たる効能及び効果、薬理作用、投与形態並びに臨床上の位置付けが同一、又は同一とみなせる既収載品
(以下「先行品」という。)があり、当該先行品の薬価収載の日から5年を経過した後に薬価収載されるもの。ただし、補
正加算に該当する場合又は開発の経緯や臨床試験等から臨床的意義が認められる場合を除く。
(2)ラセミ体又は先行品が存在する新薬の特例
当該ラセミ体の既収載品又は当該先行品を比較薬とした類似薬効比較方式(Ⅰ)によって算定される額に100分の80を乗じて
得た額(補正加算の対象となる場合には当該額に補正加算を行った額)を当該新薬の薬価とする。ただし、類似薬効比較方式
(Ⅱ)の要件にも該当し、当該算定額がより低い場合は、類似薬効比較方式(Ⅱ)によって算定される額を当該新薬の薬価と
する。
17