よむ、つかう、まなぶ。
薬ー1参考1 (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41478.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第225回 7/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
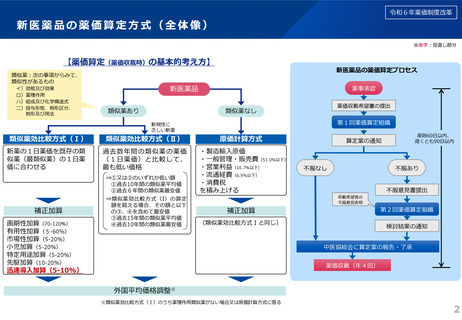
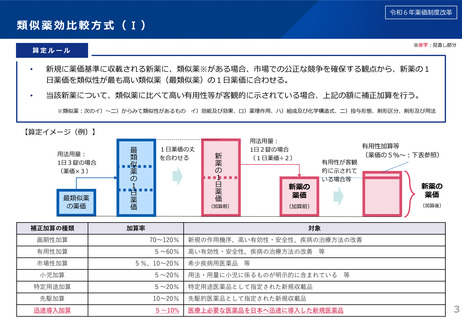
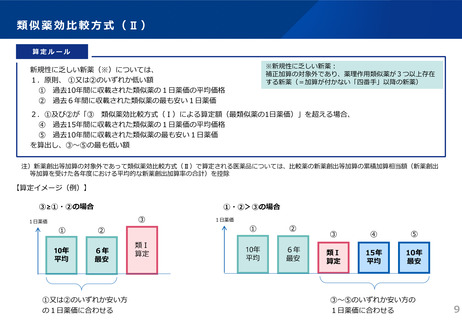
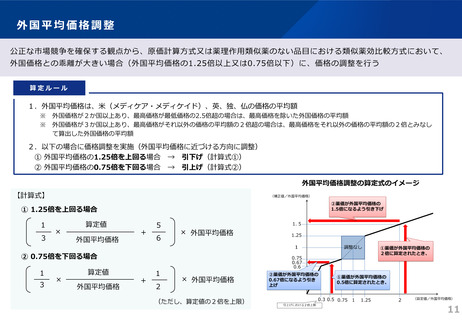
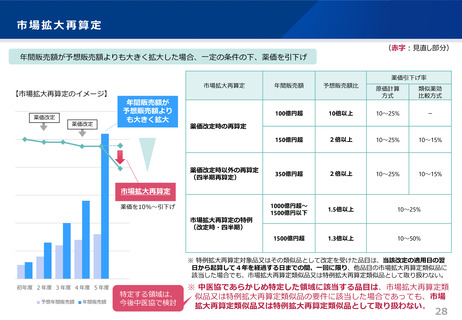
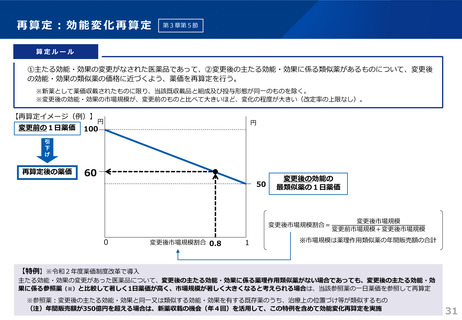
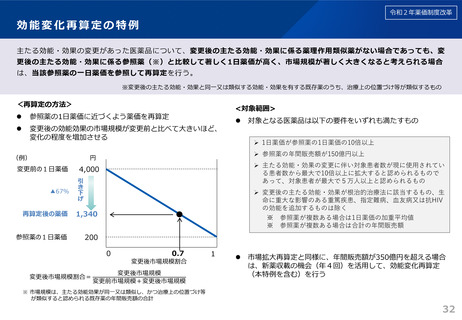
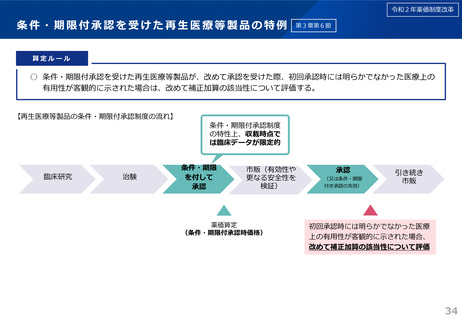
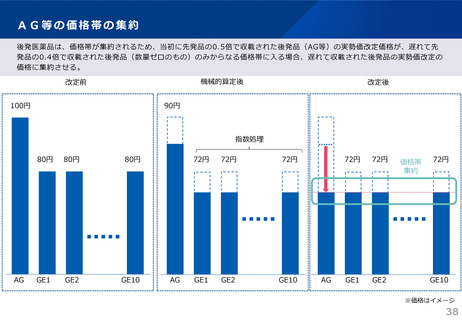
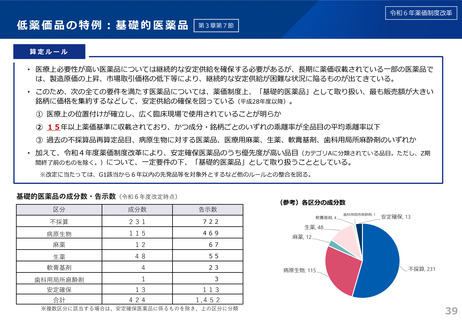
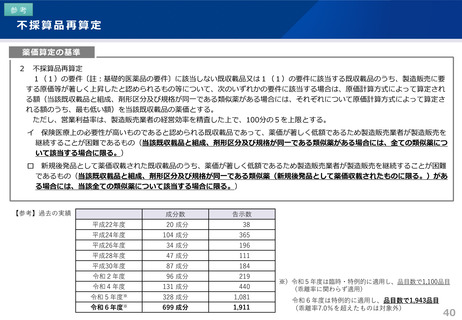
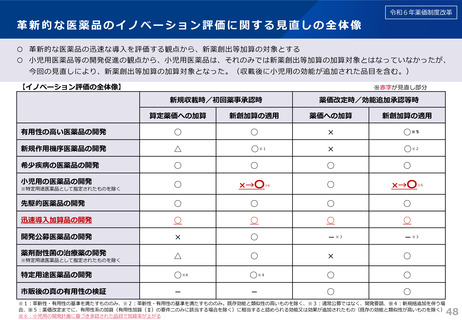
令和6年薬価制度改革
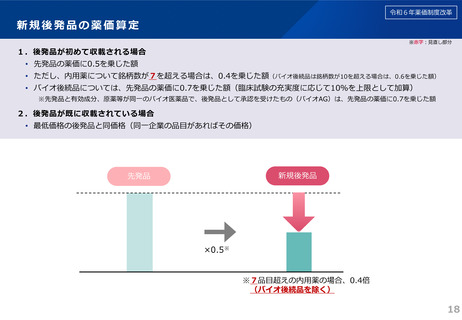
新規後発品の薬価算定
※赤字:見直し部分
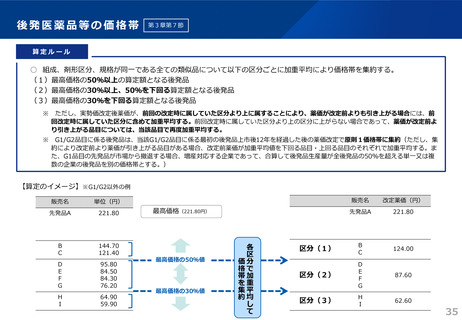
1.後発品が初めて収載される場合
• 先発品の薬価に0.5を乗じた額
• ただし、内用薬について銘柄数が7を超える場合は、0.4を乗じた額(バイオ後続品は銘柄数が10を超える場合は、0.6を乗じた額)
• バイオ後続品については、先発品の薬価に0.7を乗じた額(臨床試験の充実度に応じて10%を上限として加算)
※先発品と有効成分、原薬等が同一のバイオ医薬品で、後発品として承認を受けたもの(バイオAG)は、先発品の薬価に0.7を乗じた額
2.後発品が既に収載されている場合
• 最低価格の後発品と同価格(同一企業の品目があればその価格)
新規後発品
先発品
×0.5※
※7品目超えの内用薬の場合、0.4倍
(バイオ後続品を除く)
18
新規後発品の薬価算定
※赤字:見直し部分
1.後発品が初めて収載される場合
• 先発品の薬価に0.5を乗じた額
• ただし、内用薬について銘柄数が7を超える場合は、0.4を乗じた額(バイオ後続品は銘柄数が10を超える場合は、0.6を乗じた額)
• バイオ後続品については、先発品の薬価に0.7を乗じた額(臨床試験の充実度に応じて10%を上限として加算)
※先発品と有効成分、原薬等が同一のバイオ医薬品で、後発品として承認を受けたもの(バイオAG)は、先発品の薬価に0.7を乗じた額
2.後発品が既に収載されている場合
• 最低価格の後発品と同価格(同一企業の品目があればその価格)
新規後発品
先発品
×0.5※
※7品目超えの内用薬の場合、0.4倍
(バイオ後続品を除く)
18