よむ、つかう、まなぶ。
薬ー1参考1 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41478.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第225回 7/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
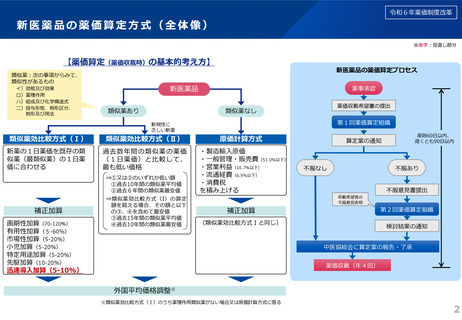
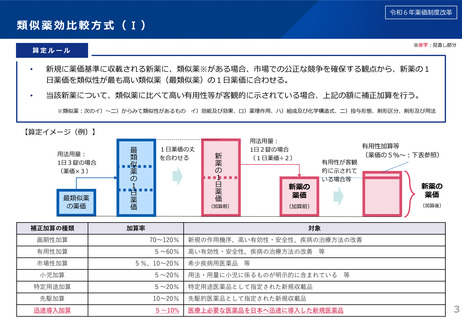
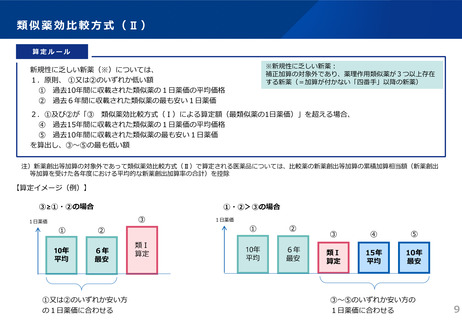
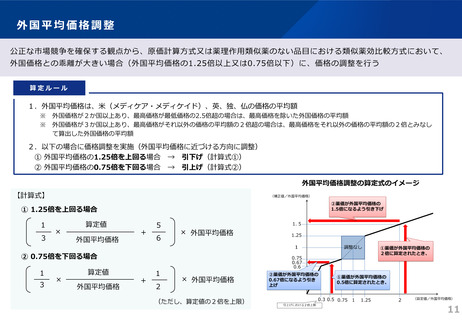
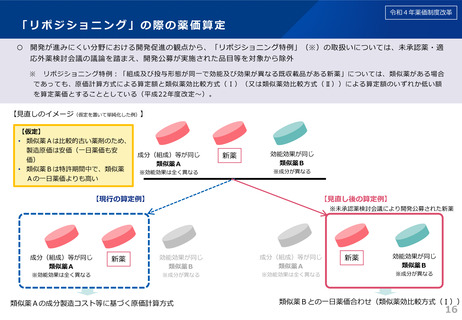
令和6年薬価制度改革
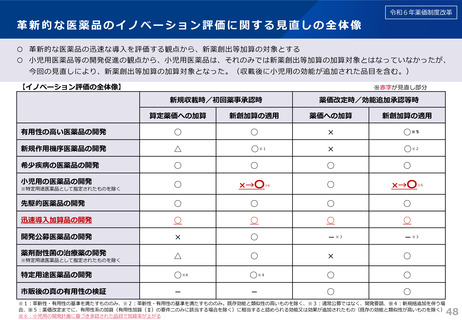
日本への迅速導入に関する評価(迅速導入加算)
(令和6年度新設)
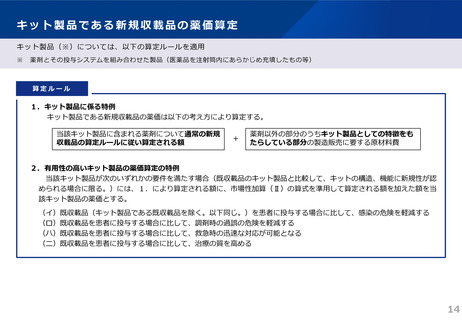
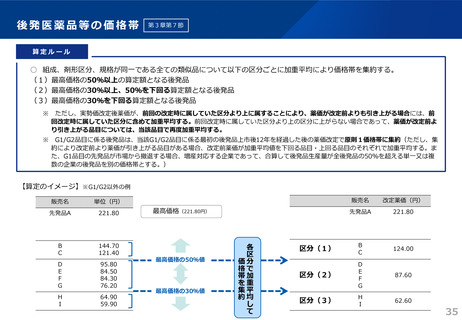
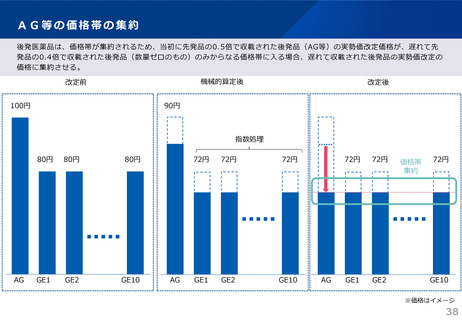
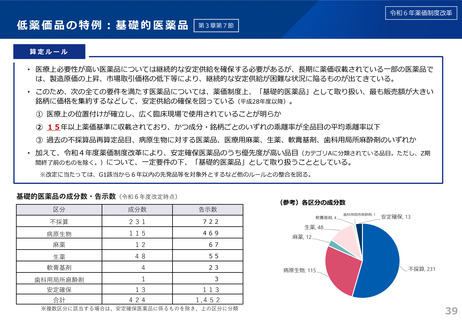
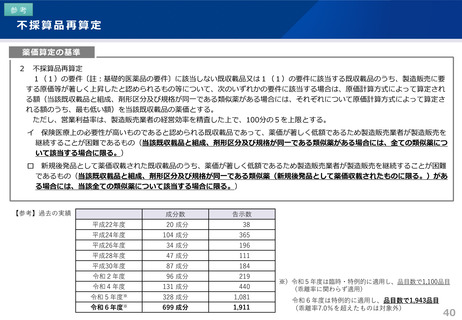
算定ルール
• 薬事制度の先駆的医薬品に対応する先駆加算に準じた取扱いとして、新規収載時に以下の要件を全て満たす品目につい
て、迅速導入加算 (A=5~10%)を適用。
➢ 日本において、国際共同試験の実施により開発された品目 又は 海外と同時若しくは海外より先に臨床試験を実施して開発された
品目
➢ 医薬品医療機器等法における優先審査品目
➢ その効能・効果に関し、承認申請が欧米より早い 又は 欧米で最も早い申請から6か月以内の品目
➢ その効能・効果に関し、承認が欧米より早い 又は 欧米で最も早い承認から6か月以内の品目
• 上記の要件を満たして効能追加がなされた品目について、改定時加算、市場拡大再算定における補正加算を適用。
【 適用イメージ 】
承認申請が 欧米より早いか 6か月以内
承認が 欧米より早いか 6か月以内
日本における承認申請時期
欧米における承認申請時期
承認申請
参
承認
考
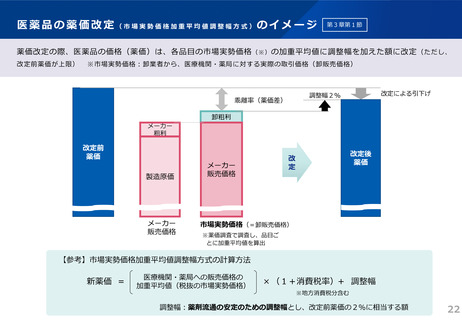
【先駆加算】(A=10~20%)
・医薬品医療機器等法に基づき先駆的医薬品として指定されたもの(旧制度での指定品目を含む)
※ 先駆的医薬品の指定要件:(1) 治療薬の画期性、(2) 対象疾患の重篤性、(3) 対象疾患に係る極めて高い有効性、
(4) 世界に先駆けて日本で早期開発・申請する意思・体制(世界に先駆けて申請 又は 最初の国の申請から3か月以内)
5
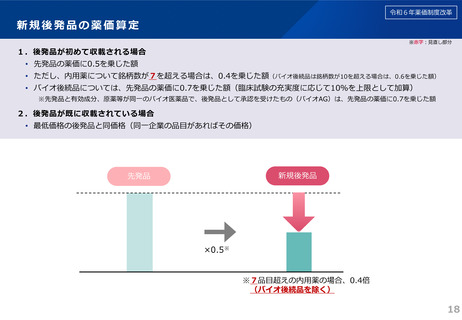
日本への迅速導入に関する評価(迅速導入加算)
(令和6年度新設)
算定ルール
• 薬事制度の先駆的医薬品に対応する先駆加算に準じた取扱いとして、新規収載時に以下の要件を全て満たす品目につい
て、迅速導入加算 (A=5~10%)を適用。
➢ 日本において、国際共同試験の実施により開発された品目 又は 海外と同時若しくは海外より先に臨床試験を実施して開発された
品目
➢ 医薬品医療機器等法における優先審査品目
➢ その効能・効果に関し、承認申請が欧米より早い 又は 欧米で最も早い申請から6か月以内の品目
➢ その効能・効果に関し、承認が欧米より早い 又は 欧米で最も早い承認から6か月以内の品目
• 上記の要件を満たして効能追加がなされた品目について、改定時加算、市場拡大再算定における補正加算を適用。
【 適用イメージ 】
承認申請が 欧米より早いか 6か月以内
承認が 欧米より早いか 6か月以内
日本における承認申請時期
欧米における承認申請時期
承認申請
参
承認
考
【先駆加算】(A=10~20%)
・医薬品医療機器等法に基づき先駆的医薬品として指定されたもの(旧制度での指定品目を含む)
※ 先駆的医薬品の指定要件:(1) 治療薬の画期性、(2) 対象疾患の重篤性、(3) 対象疾患に係る極めて高い有効性、
(4) 世界に先駆けて日本で早期開発・申請する意思・体制(世界に先駆けて申請 又は 最初の国の申請から3か月以内)
5