よむ、つかう、まなぶ。
04 資料1-2_ワクチンの研究開発について (31 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43850.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会研究開発及び生産・流通部会(第36回 9/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
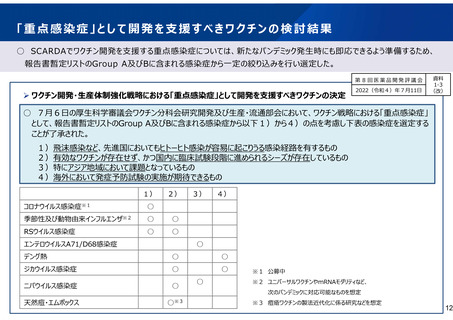
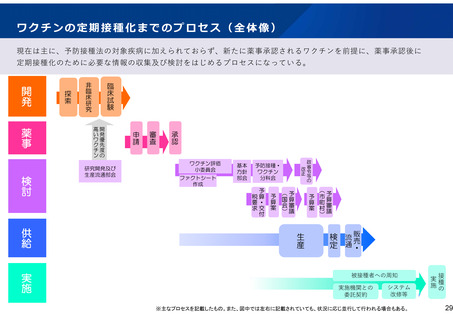
「ワクチン開発・生産体制強化戦略」における
重点感染症に係る方針
第27回厚生科学審議会予防接種・ワクチン分科会
研 究 開 発 及び 生 産 ・流通 部 会
2022(令和4)年3月23日
資料
1
(改)
(令和3年6月1日閣議決定)
2.7 ワクチン開発・製造産業の育成・振興【厚◎、外】
•
•
ワクチン開発は企業にとってリスクの高い事業である。がん、高血圧、糖尿病など高齢化社会に伴う安定的な収益が見込める医薬品事業に対し、
いつ、どれだけの規模で発生するかわからない感染症のために、平時から、ワクチン開発に企業が積極的に取り組むことに経済的合理性はない。
このため、政府が開発を主導することが不可欠となる。
また、市場性の低いワクチンの開発を支援するGHITやCEPIといった国際的な枠組みを通じて企業の開発を後押しすることも重要である。さらに、
ワクチンを開発した企業が、投資が回収できる見込みが立つように仕組みを作ることが、企業の継続的な研究開発投資、生産の判断に不可欠
である。
(中略)
•
このため、厚生労働省内に、今後のパンデミックに備えるべき重点感染症を決定し、ワクチン開発の経験を重ねる観点からも、それに対する
ワクチンや治療薬等の企業開発支援を行うとともに、前述のSCARDAへの助言、ワクチンや治療薬等の原材料・資材の国内自給による安定
供給を目指した国産化の促進や、必要な場合には備蓄を検討したり、緊急時にはワクチンや治療薬等を確保するための企業との交渉も行ったり
する体制を構築する。なお、医薬品の安全性、有効性を監督する立場の規制部門は別の部署とする。
2.9 ワクチン開発の前提としてのモニタリング体制の拡充【文、厚◎】
•
ワクチンの研究開発を迅速に進めるためには、国内外の新興・再興感染症の最新の発生状況、ウイルスの感染力やゲノム情報、症状など
臨床情報を迅速に収集し、分析することが重要である。また、変異株の発生等も踏まえ、接種後のワクチンの効果を評価し、新たなワクチン
•
研究開発につなげることも不可欠である。
このため、国立感染症研究所、国立国際医療研究センターを中心に、大学・研究機関、地方公共団体、民間等が海外からの情報も
•
入手の上、産官学連携を強化することが重要である。
そうした関係者の協力の下、厚生労働省において国際的に脅威となりうる感染症について、国内外における流行状況を把握し、我が国に
•
おいてワクチン等の確保・研究開発が必要な感染症を特定する必要がある。
また今回、他国が先行した事例を踏まえ、前述のSCARDA 等も活用しつつ、分野や地域を問わない新規モダリティの開発状況や国内外の
企業やベンチャーの動向等について、前述のAMED に新設する先進的研究開発戦略センターSCARDA 等も活用しつつ把握できる幅広い
インテリジェンスの集約体制を構築する。
31
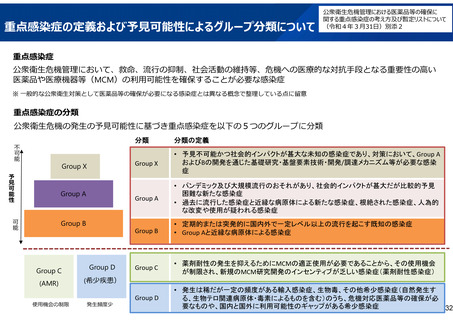
重点感染症に係る方針
第27回厚生科学審議会予防接種・ワクチン分科会
研 究 開 発 及び 生 産 ・流通 部 会
2022(令和4)年3月23日
資料
1
(改)
(令和3年6月1日閣議決定)
2.7 ワクチン開発・製造産業の育成・振興【厚◎、外】
•
•
ワクチン開発は企業にとってリスクの高い事業である。がん、高血圧、糖尿病など高齢化社会に伴う安定的な収益が見込める医薬品事業に対し、
いつ、どれだけの規模で発生するかわからない感染症のために、平時から、ワクチン開発に企業が積極的に取り組むことに経済的合理性はない。
このため、政府が開発を主導することが不可欠となる。
また、市場性の低いワクチンの開発を支援するGHITやCEPIといった国際的な枠組みを通じて企業の開発を後押しすることも重要である。さらに、
ワクチンを開発した企業が、投資が回収できる見込みが立つように仕組みを作ることが、企業の継続的な研究開発投資、生産の判断に不可欠
である。
(中略)
•
このため、厚生労働省内に、今後のパンデミックに備えるべき重点感染症を決定し、ワクチン開発の経験を重ねる観点からも、それに対する
ワクチンや治療薬等の企業開発支援を行うとともに、前述のSCARDAへの助言、ワクチンや治療薬等の原材料・資材の国内自給による安定
供給を目指した国産化の促進や、必要な場合には備蓄を検討したり、緊急時にはワクチンや治療薬等を確保するための企業との交渉も行ったり
する体制を構築する。なお、医薬品の安全性、有効性を監督する立場の規制部門は別の部署とする。
2.9 ワクチン開発の前提としてのモニタリング体制の拡充【文、厚◎】
•
ワクチンの研究開発を迅速に進めるためには、国内外の新興・再興感染症の最新の発生状況、ウイルスの感染力やゲノム情報、症状など
臨床情報を迅速に収集し、分析することが重要である。また、変異株の発生等も踏まえ、接種後のワクチンの効果を評価し、新たなワクチン
•
研究開発につなげることも不可欠である。
このため、国立感染症研究所、国立国際医療研究センターを中心に、大学・研究機関、地方公共団体、民間等が海外からの情報も
•
入手の上、産官学連携を強化することが重要である。
そうした関係者の協力の下、厚生労働省において国際的に脅威となりうる感染症について、国内外における流行状況を把握し、我が国に
•
おいてワクチン等の確保・研究開発が必要な感染症を特定する必要がある。
また今回、他国が先行した事例を踏まえ、前述のSCARDA 等も活用しつつ、分野や地域を問わない新規モダリティの開発状況や国内外の
企業やベンチャーの動向等について、前述のAMED に新設する先進的研究開発戦略センターSCARDA 等も活用しつつ把握できる幅広い
インテリジェンスの集約体制を構築する。
31