よむ、つかう、まなぶ。
資料1-2 ベポタスチンのリスク区分について[5.2MB] (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
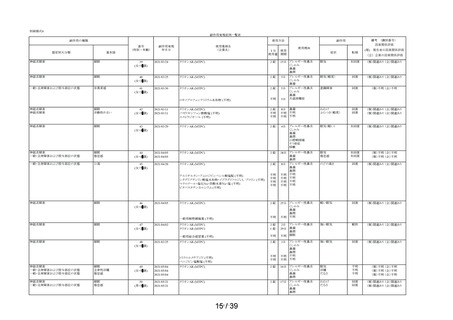
Ⅲ.今後の安全対策
Ⅲ-1 安全確保措置について
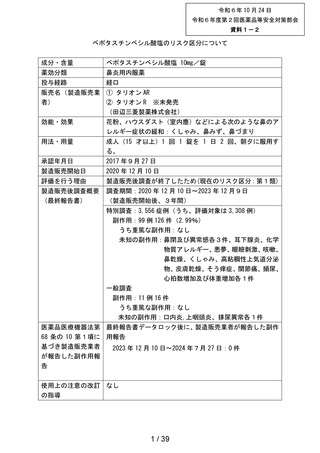
本剤の副作用頻度調査において重篤な副作用の発現は認められなかった。
本剤の副作用発現症例率 2.99%(99/3,308 例)は、本剤承認前の調査結果である医療用タリオン
の使用成績調査の副作用発現症例率 2.00% (89/4,453 例)と比較してほぼ同程度であった。また、
本剤の発現例数の多い副作用(上位 3 事象)は「傾眠」、
「口渇」、
「倦怠感」であり、医療用タリ
オンの使用成績調査においても発現例数の上位 10 事象に含まれる事象であり、頻度、種類ともに
異なる副作用の発現は認められなかった。
以上の結果を踏まえ、現時点で「使用上の注意」の改訂を含む安全確保措置を講ずる必要はない
と考える。
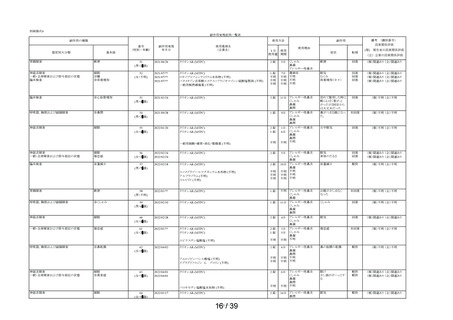
Ⅲ-2 適正使用について
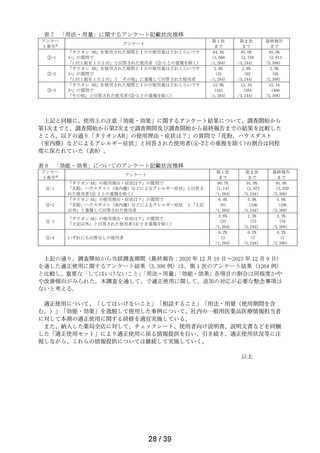
本剤の適正使用状況を確認する事項として調査した使用上の注意の「してはいけないこと」の
該当者(適正使用を守られてない方)の割合について、調査開始から第 1 次までと、調査開始か
ら第 2 次まで調査期間及び調査開始から最終報告までの結果を比較したところ、以下の通り各項
目の割合は同程度かやや改善傾向がみられた(表 6)。
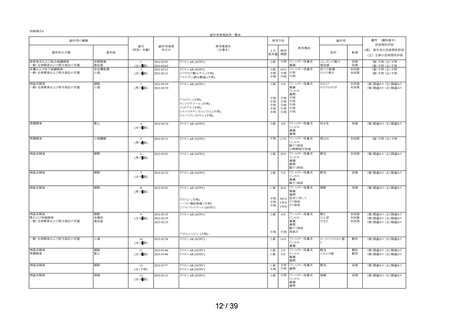
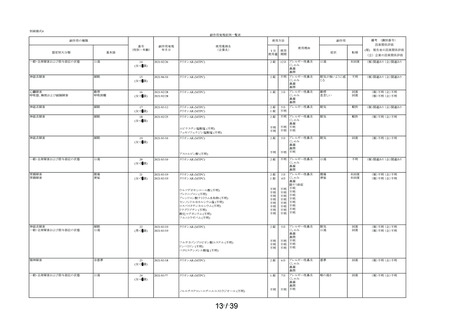
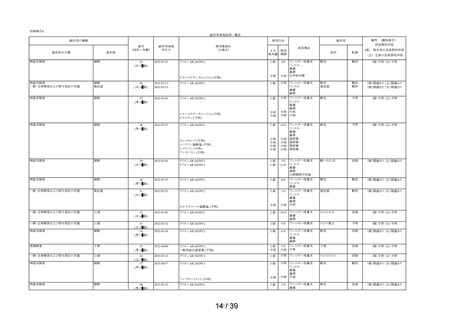
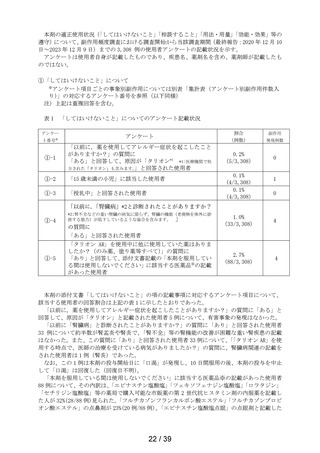
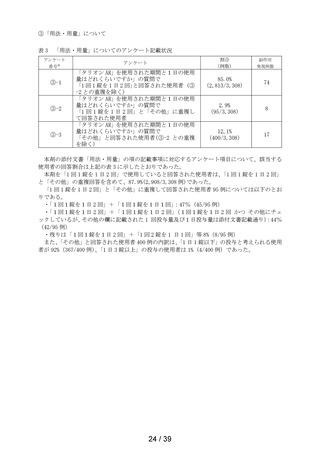
表 6 「してはいけないこと」についてアンケート記載状況推移
アンケー
ト番号※
アンケート
第1次
まで
第2次
まで」
最終報告
まで
①-1
「以前に,薬を使用してアレルギー症状を起こしたことがあります
か? の質問に
「ある」と回答して、原因が「タリオン*1 *1:医療機関で処方された
「タリオン」も含みます。
」と回答された使用者
0.3%
(4
/1,264)
0.2%
(5
/3,244)
0.2%
(5
/3,308)
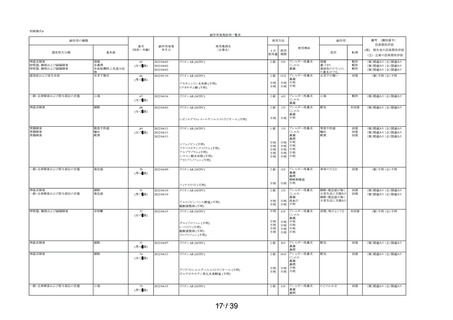
① 2
「15 歳未満の小児」に該当した使用者
①-3
「授乳中」と回答された使用者
0.1%
(1
/1,264)
0.1%
(1
/1,264)
0.1%
(4
/3,244)
0.1%
(4
/3,244)
0.1%
(4
/3,308)
0.1%
(4
/3,308)
①-4
「以前に,「腎臓病」*2と診断されたことがありますか?
*2;腎不全などの重い腎臓の病気に限らず、腎臓の機能(老廃物を体
外に排泄する能力)が低下しているような場合を含みます。 」
の質問に
「ある」と回答された使用者
1.3%
(16
/1,264)
1.0%
(33
/3,244)
1.0%
(33
/3,308)
①-5
「タリオン AR」を使用中に他に使用していた薬はありましたか?(の
み薬、塗り薬等すべて)」の質問に
「あり」と回答して、添付文書記載の「本剤を服用している間は使用
しないでください」に該当する医薬品※の記載があった使用者
3.6%
(46
/1,264)
2.7%
(88
/3,244)
2.7%
(88
/3,308)
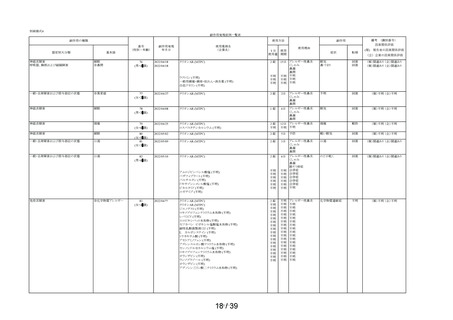
注)本剤の副作用頻度調査のこれまでの期間及び安全性集計対象例数は以下の通りである。
・調査開始から第 1 次まで
(2020 年 12 月 10 日~2021 年 12 月 9 日)
(安全性集計対象例数 1,264 例)
・調査開始から第 2 次まで
(2020 年 12 月 10 日~2022 年 12 月 9 日)
(安全性集計対象例数 3,244 例)
・調査開始から最終報告まで
(2020 年 12 月 10 日~2023 年 12 月 9 日)
(安全性集計対象例数 3,308 例)
上記と同様に、使用上の注意「用法・用量」に関するアンケート結果について、調査開始から
第 1 次までと、調査開始から第 2 次まで調査期間及び調査開始から最終報告までの結果を比較し
たところ、以下の通り「タリオン AR」を使用された期間と1日の使用量はどれくらいですか」の
質問で「1 回 1 錠を 1 日 2 回」と回答された使用者 (③-2 との重複を除く)の割合は同程度に保た
れていた(表 7)。
27 / 39
Ⅲ-1 安全確保措置について
本剤の副作用頻度調査において重篤な副作用の発現は認められなかった。
本剤の副作用発現症例率 2.99%(99/3,308 例)は、本剤承認前の調査結果である医療用タリオン
の使用成績調査の副作用発現症例率 2.00% (89/4,453 例)と比較してほぼ同程度であった。また、
本剤の発現例数の多い副作用(上位 3 事象)は「傾眠」、
「口渇」、
「倦怠感」であり、医療用タリ
オンの使用成績調査においても発現例数の上位 10 事象に含まれる事象であり、頻度、種類ともに
異なる副作用の発現は認められなかった。
以上の結果を踏まえ、現時点で「使用上の注意」の改訂を含む安全確保措置を講ずる必要はない
と考える。
Ⅲ-2 適正使用について
本剤の適正使用状況を確認する事項として調査した使用上の注意の「してはいけないこと」の
該当者(適正使用を守られてない方)の割合について、調査開始から第 1 次までと、調査開始か
ら第 2 次まで調査期間及び調査開始から最終報告までの結果を比較したところ、以下の通り各項
目の割合は同程度かやや改善傾向がみられた(表 6)。
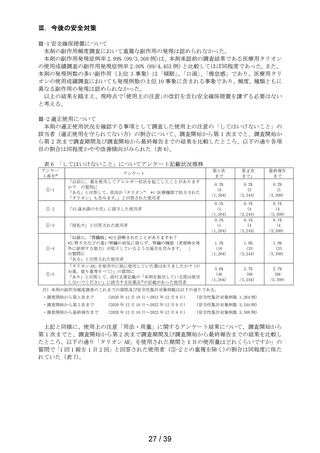
表 6 「してはいけないこと」についてアンケート記載状況推移
アンケー
ト番号※
アンケート
第1次
まで
第2次
まで」
最終報告
まで
①-1
「以前に,薬を使用してアレルギー症状を起こしたことがあります
か? の質問に
「ある」と回答して、原因が「タリオン*1 *1:医療機関で処方された
「タリオン」も含みます。
」と回答された使用者
0.3%
(4
/1,264)
0.2%
(5
/3,244)
0.2%
(5
/3,308)
① 2
「15 歳未満の小児」に該当した使用者
①-3
「授乳中」と回答された使用者
0.1%
(1
/1,264)
0.1%
(1
/1,264)
0.1%
(4
/3,244)
0.1%
(4
/3,244)
0.1%
(4
/3,308)
0.1%
(4
/3,308)
①-4
「以前に,「腎臓病」*2と診断されたことがありますか?
*2;腎不全などの重い腎臓の病気に限らず、腎臓の機能(老廃物を体
外に排泄する能力)が低下しているような場合を含みます。 」
の質問に
「ある」と回答された使用者
1.3%
(16
/1,264)
1.0%
(33
/3,244)
1.0%
(33
/3,308)
①-5
「タリオン AR」を使用中に他に使用していた薬はありましたか?(の
み薬、塗り薬等すべて)」の質問に
「あり」と回答して、添付文書記載の「本剤を服用している間は使用
しないでください」に該当する医薬品※の記載があった使用者
3.6%
(46
/1,264)
2.7%
(88
/3,244)
2.7%
(88
/3,308)
注)本剤の副作用頻度調査のこれまでの期間及び安全性集計対象例数は以下の通りである。
・調査開始から第 1 次まで
(2020 年 12 月 10 日~2021 年 12 月 9 日)
(安全性集計対象例数 1,264 例)
・調査開始から第 2 次まで
(2020 年 12 月 10 日~2022 年 12 月 9 日)
(安全性集計対象例数 3,244 例)
・調査開始から最終報告まで
(2020 年 12 月 10 日~2023 年 12 月 9 日)
(安全性集計対象例数 3,308 例)
上記と同様に、使用上の注意「用法・用量」に関するアンケート結果について、調査開始から
第 1 次までと、調査開始から第 2 次まで調査期間及び調査開始から最終報告までの結果を比較し
たところ、以下の通り「タリオン AR」を使用された期間と1日の使用量はどれくらいですか」の
質問で「1 回 1 錠を 1 日 2 回」と回答された使用者 (③-2 との重複を除く)の割合は同程度に保た
れていた(表 7)。
27 / 39