よむ、つかう、まなぶ。
03【資料1】新型コロナワクチンの接種について (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27763.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第36回 9/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.本日の論点:【2】小児に対する新型コロナワクチンの接種について
(1)5~11歳の小児に対する追加接種について ① 有効性、安全性及び諸外国等の状況について
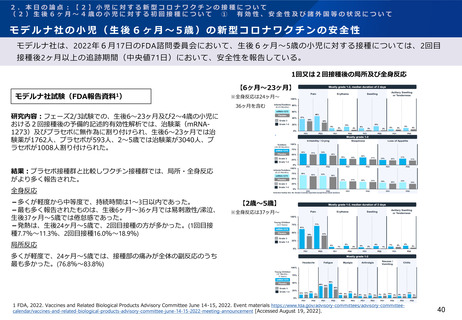
ファイザー社の小児(5歳~11歳)の新型コロナワクチンの有効性(審査報告書)
PMDAは審査報告書において、5~11歳の小児におけるファイザー社ワクチンについて、免疫原性成績や他の年齢層
でオミクロン株流行期におけるコミナティ3回目接種の有効性を示唆する報告を踏まえると、5~11歳の小児に対して
も本剤3回目接種の有効性が期待できると判断している。
ファイザー社臨床試験(PMDA提出資料)
ファイザー社からの報告(概要・抜粋):
・C4591007試験※1の第Ⅱ/Ⅲ相パートで初回免疫として本剤2回接種【3回目接種後の中和抗体価】
を受けた5~11歳の全被験者に対して、2回目接種から少なくとも6カ
月経過後に本剤3回目接種したときの安全性及び免疫原性を検討。
・中間解析の結果、参照株に対する中和抗体価(中和法)は、3回目接
種後のGMTで2回目接種後よりも高く、2回目接種後に対する3回目接
種後のGMR※2は感染歴のない集団で2.17、感染歴を問わない集団で
2.53であった(右上表)。
・オミクロン株(B.1.1.529)に対する中和抗体価(蛍光フォーカス減
少中和法)を探索的に評価した結果は右下表のとおりであり、感染歴
のない集団において3回目接種後のGMTは2回目接種後よりも約22倍高
かった。
GMR:2.17
GMR:2.53
PMDAの判断(概要・抜粋):
・成人の初回免疫の開発において、国内臨床試験で海外臨床試験と同 【オミクロン株(B.1.1.529)に対する中和抗体価】
程度以上の免疫応答が確認されたこと、5~11歳の小児の初回免疫の
開発において、海外臨床試験で5~11歳の小児の免疫応答は若年成人
と同様であることが確認されたこと、C4591007試験の成績等を踏ま
えると、本剤3回目接種の有効性が期待できる。
・SARS-CoV-2の新たな変異株の出現が推測されること、他の年齢層
で追加免疫後の有効性は時間と共に減弱するとの報告があることを踏
まえ、今後各国で蓄積される情報等から随時情報収集し、必要な対応
を検討する必要がある。
・変異株については、今後も発現状況及び流行状況に注視し、状況に
応じた対応を検討する必要がある。
※1 初回免疫後の観察期間中であったC4591007試験の計画を変更して実施された。
※2 GMRは、3回目接種後1カ月のGMT/2回目接種後1カ月のGMTにより算出。
2回目接種後と比較した3回目接種後の
中和抗体価の比(GMR)は約22倍。
23
(1)5~11歳の小児に対する追加接種について ① 有効性、安全性及び諸外国等の状況について
ファイザー社の小児(5歳~11歳)の新型コロナワクチンの有効性(審査報告書)
PMDAは審査報告書において、5~11歳の小児におけるファイザー社ワクチンについて、免疫原性成績や他の年齢層
でオミクロン株流行期におけるコミナティ3回目接種の有効性を示唆する報告を踏まえると、5~11歳の小児に対して
も本剤3回目接種の有効性が期待できると判断している。
ファイザー社臨床試験(PMDA提出資料)
ファイザー社からの報告(概要・抜粋):
・C4591007試験※1の第Ⅱ/Ⅲ相パートで初回免疫として本剤2回接種【3回目接種後の中和抗体価】
を受けた5~11歳の全被験者に対して、2回目接種から少なくとも6カ
月経過後に本剤3回目接種したときの安全性及び免疫原性を検討。
・中間解析の結果、参照株に対する中和抗体価(中和法)は、3回目接
種後のGMTで2回目接種後よりも高く、2回目接種後に対する3回目接
種後のGMR※2は感染歴のない集団で2.17、感染歴を問わない集団で
2.53であった(右上表)。
・オミクロン株(B.1.1.529)に対する中和抗体価(蛍光フォーカス減
少中和法)を探索的に評価した結果は右下表のとおりであり、感染歴
のない集団において3回目接種後のGMTは2回目接種後よりも約22倍高
かった。
GMR:2.17
GMR:2.53
PMDAの判断(概要・抜粋):
・成人の初回免疫の開発において、国内臨床試験で海外臨床試験と同 【オミクロン株(B.1.1.529)に対する中和抗体価】
程度以上の免疫応答が確認されたこと、5~11歳の小児の初回免疫の
開発において、海外臨床試験で5~11歳の小児の免疫応答は若年成人
と同様であることが確認されたこと、C4591007試験の成績等を踏ま
えると、本剤3回目接種の有効性が期待できる。
・SARS-CoV-2の新たな変異株の出現が推測されること、他の年齢層
で追加免疫後の有効性は時間と共に減弱するとの報告があることを踏
まえ、今後各国で蓄積される情報等から随時情報収集し、必要な対応
を検討する必要がある。
・変異株については、今後も発現状況及び流行状況に注視し、状況に
応じた対応を検討する必要がある。
※1 初回免疫後の観察期間中であったC4591007試験の計画を変更して実施された。
※2 GMRは、3回目接種後1カ月のGMT/2回目接種後1カ月のGMTにより算出。
2回目接種後と比較した3回目接種後の
中和抗体価の比(GMR)は約22倍。
23