よむ、つかう、まなぶ。
03【資料1】新型コロナワクチンの接種について (38 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27763.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第36回 9/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.本日の論点: 【2】小児に対する新型コロナワクチンの接種について
(2)生後6ヶ月~4歳の小児に対する初回接種について ①
有効性、安全性及び諸外国等の状況について
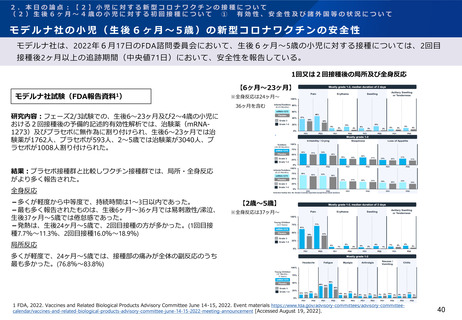
モデルナ社の小児(生後6ヶ月~5歳)の新型コロナワクチンの免疫原性
モデルナ社は、2022年6月17日のFDA諮問委員会において、生後6ヶ月~5歳の小児に対する接種については、事前
に設定した免疫原性基準を満たし、また、GMT比率等について若年成人と比較して非劣性であったと報告している。
モデルナ社試験(FDA報告資料1)
2回接種後のGMR及び血清反応(18-25歳との比較)
研究内容:フェーズ2/3試験での、生後6~23ヶ月及び2~4
歳の小児におけるSARS-CoV-2感染歴のない免疫原性評価対
象集団において、SARS-CoV-2中和GMTと血清反応率を年
齢群ごとに評価。
結果:2回接種後57日までの参加者において、生後6~23ヶ
月(比較対照群18~25歳)では、SARS-CoV-2 GMTの比率
は1.28(95%CI:1.12, 1.47)、2-5歳の参加者において
は1.01(95%CI:0.88,1.17)であった。
2回接種後のGMRの比較(6歳-25歳との比較)
1 FDA, 2022. Vaccines and Related Biological Products Advisory Committee June 14-15, 2022. Event materials https://www.fda.gov/advisory-committees/advisory-committeecalendar/vaccines-and-related-biological-products-advisory-committee-june-14-15-2022-meeting-announcement [Accessed August 19, 2022].
38
(2)生後6ヶ月~4歳の小児に対する初回接種について ①
有効性、安全性及び諸外国等の状況について
モデルナ社の小児(生後6ヶ月~5歳)の新型コロナワクチンの免疫原性
モデルナ社は、2022年6月17日のFDA諮問委員会において、生後6ヶ月~5歳の小児に対する接種については、事前
に設定した免疫原性基準を満たし、また、GMT比率等について若年成人と比較して非劣性であったと報告している。
モデルナ社試験(FDA報告資料1)
2回接種後のGMR及び血清反応(18-25歳との比較)
研究内容:フェーズ2/3試験での、生後6~23ヶ月及び2~4
歳の小児におけるSARS-CoV-2感染歴のない免疫原性評価対
象集団において、SARS-CoV-2中和GMTと血清反応率を年
齢群ごとに評価。
結果:2回接種後57日までの参加者において、生後6~23ヶ
月(比較対照群18~25歳)では、SARS-CoV-2 GMTの比率
は1.28(95%CI:1.12, 1.47)、2-5歳の参加者において
は1.01(95%CI:0.88,1.17)であった。
2回接種後のGMRの比較(6歳-25歳との比較)
1 FDA, 2022. Vaccines and Related Biological Products Advisory Committee June 14-15, 2022. Event materials https://www.fda.gov/advisory-committees/advisory-committeecalendar/vaccines-and-related-biological-products-advisory-committee-june-14-15-2022-meeting-announcement [Accessed August 19, 2022].
38