よむ、つかう、まなぶ。
総-4-2○最適使用推進ガイドラインについて (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00160.html |
| 出典情報 | 中央社会保険医療協議会 総会(第528回 9/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
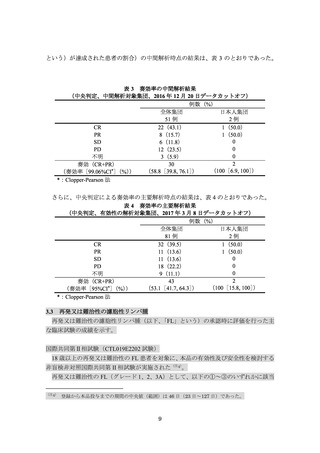
3.臨床成績
【有効性】
3.1
小児及び若年成人(AYA)の再発又は難治性の B 細胞性急性リンパ芽球性白血病
小児及び AYA の再発又は難治性の B 細胞性急性リンパ芽球性白血病(以下、
「B-ALL」
という)の承認時に評価を行った主な臨床試験の成績を示す。
国際共同第Ⅱ相試験(CTL019B2202 試験)
(注1)
3 歳(スクリーニング時)~21 歳(B-ALL の初回診断時)
の再発又は難治性の B-
ALL 患者を対象に、本品の有効性及び安全性を検討する非盲検非対照国際共同第 II 相
試験が実施された(注2)。
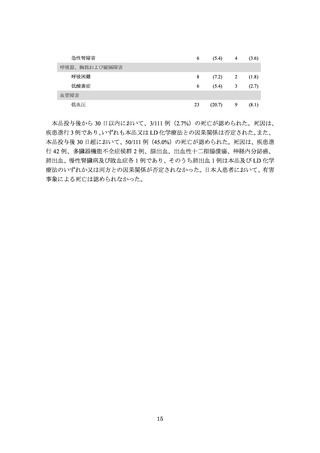
再発又は難治性の B-ALL 患者として、以下の①~⑤のいずれかに該当する患者が組
み入れられた。なお、悪性腫瘍(白血病)の活動性の中枢神経系浸潤のある患者及び髄
外単独病変の再発のある患者は除外された。
①2 回以上の骨髄再発が認められた、②同種造血幹細胞移植(以下、
「HSCT」という)
後に骨髄再発し、
本品投与時点で同種 HSCT から 6 カ月以上経過している、
③同種 HSCT
の適応がない、④標準の化学療法レジメンを 2 サイクル受けた後でも寛解を達成しない
と定義される初発難治性、又は再発した白血病に対して標準の化学療法を 1 サイクル受
けた後でも寛解を達成しないと定義される化学療法難治性、⑤フィラデルフィア染色体
陽性の患者の場合には、チロシンキナーゼ阻害剤(TKI)不耐又は禁忌、2 種類以上の
TKI を受けても奏効が得られない。
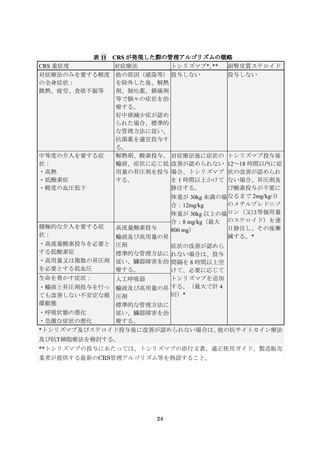
本品の用法及び用量又は使用方法は、体重 50 kg 以下の場合には目標用量(本品の製
造において目標とされる用量)2.0×106~5.0×106 個/kg(許容用量(本品の投与が許容
される用量):0.2×106~5.0×106 個/kg)
、体重 50 kg 超の場合には目標用量 1.0×108~
2.5×108 個(許容用量:0.1×108~2.5×108 個)を単回静脈内投与することとされた。
なお、生体内での本品の生着と増殖を促進することを目的として、本品の投与予定日
の 1 週間前以内の末梢血白血球数が 1,000/µL を超える場合、本品投与の 2 日前までに
以下の LD 化学療法を前処置として行うこととされた。
(1)前処置の化学療法(LD 化学療法)
投与前の前処置として以下の化学療法剤を用いた(ただし、本品の投与前の 1 週間以
内の白血球数が 1,000/µL 以下の場合には不要とした)。化学療法の完了から本品投与ま
でに 2~14 日の間隔を設けた。なお、患者の状態により適宜減量した。
フルダラビンリン酸エステル(30 mg/m2 を 1 日 1 回、計 4 日静注)
、及びシクロ
ホスファミド[(無水物として)500 mg/m2 を 1 日 1 回、計 2 日静注。シクロホス
ファミドの投与は最初のフルダラビンリン酸エステル投与と同時に開始する。
]
(注1)
3~23 歳までの患者が組み入れられた。なお、B-ALL 患者を対象に、本品の有効性及び安全性を検討
する非盲検非対照海外第Ⅱ相試験(B2205J 試験)では、3~25 歳までの患者が組入れられた。
(注2)
登録から本品投与までの期間の中央値(範囲)は 45 日(30 日~105 日)であった。
6
【有効性】
3.1
小児及び若年成人(AYA)の再発又は難治性の B 細胞性急性リンパ芽球性白血病
小児及び AYA の再発又は難治性の B 細胞性急性リンパ芽球性白血病(以下、
「B-ALL」
という)の承認時に評価を行った主な臨床試験の成績を示す。
国際共同第Ⅱ相試験(CTL019B2202 試験)
(注1)
3 歳(スクリーニング時)~21 歳(B-ALL の初回診断時)
の再発又は難治性の B-
ALL 患者を対象に、本品の有効性及び安全性を検討する非盲検非対照国際共同第 II 相
試験が実施された(注2)。
再発又は難治性の B-ALL 患者として、以下の①~⑤のいずれかに該当する患者が組
み入れられた。なお、悪性腫瘍(白血病)の活動性の中枢神経系浸潤のある患者及び髄
外単独病変の再発のある患者は除外された。
①2 回以上の骨髄再発が認められた、②同種造血幹細胞移植(以下、
「HSCT」という)
後に骨髄再発し、
本品投与時点で同種 HSCT から 6 カ月以上経過している、
③同種 HSCT
の適応がない、④標準の化学療法レジメンを 2 サイクル受けた後でも寛解を達成しない
と定義される初発難治性、又は再発した白血病に対して標準の化学療法を 1 サイクル受
けた後でも寛解を達成しないと定義される化学療法難治性、⑤フィラデルフィア染色体
陽性の患者の場合には、チロシンキナーゼ阻害剤(TKI)不耐又は禁忌、2 種類以上の
TKI を受けても奏効が得られない。
本品の用法及び用量又は使用方法は、体重 50 kg 以下の場合には目標用量(本品の製
造において目標とされる用量)2.0×106~5.0×106 個/kg(許容用量(本品の投与が許容
される用量):0.2×106~5.0×106 個/kg)
、体重 50 kg 超の場合には目標用量 1.0×108~
2.5×108 個(許容用量:0.1×108~2.5×108 個)を単回静脈内投与することとされた。
なお、生体内での本品の生着と増殖を促進することを目的として、本品の投与予定日
の 1 週間前以内の末梢血白血球数が 1,000/µL を超える場合、本品投与の 2 日前までに
以下の LD 化学療法を前処置として行うこととされた。
(1)前処置の化学療法(LD 化学療法)
投与前の前処置として以下の化学療法剤を用いた(ただし、本品の投与前の 1 週間以
内の白血球数が 1,000/µL 以下の場合には不要とした)。化学療法の完了から本品投与ま
でに 2~14 日の間隔を設けた。なお、患者の状態により適宜減量した。
フルダラビンリン酸エステル(30 mg/m2 を 1 日 1 回、計 4 日静注)
、及びシクロ
ホスファミド[(無水物として)500 mg/m2 を 1 日 1 回、計 2 日静注。シクロホス
ファミドの投与は最初のフルダラビンリン酸エステル投与と同時に開始する。
]
(注1)
3~23 歳までの患者が組み入れられた。なお、B-ALL 患者を対象に、本品の有効性及び安全性を検討
する非盲検非対照海外第Ⅱ相試験(B2205J 試験)では、3~25 歳までの患者が組入れられた。
(注2)
登録から本品投与までの期間の中央値(範囲)は 45 日(30 日~105 日)であった。
6