よむ、つかう、まなぶ。
資料2-5 緊急承認された医薬品の市販後安全対策について (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31510.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第4回 3/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ゾコーバ錠(4)
薬剤名等
ボセンタン水和物
臨床症状・措置方法
機序・危険因子
本剤の血中濃度が減少
し、作用が減弱するお
それがある。また、ボ
センタン水和物の血中
濃度が上昇し、副作用
が発現しやすくなるお
それがある。
ボセンタン水和物の
CYP3A誘 導 作 用 に よ
り、本剤の代謝が促進
されるおそれがある。
また、本剤の C
YP3Aに
対する阻害作用によ
り、ボセンタン水和物
の代謝が阻害される。
中程度の CY
P3
A誘導剤
本剤の血中濃度が減少 これらの薬剤の CYP3A
エファビレンツ、エト し、作用が減弱するお 誘導作用により、本剤
ラビリン、フェノバル それがある。
の代謝が促進されるお
ビタール、プリミドン
それがある。
等
メトトレキサート
メトトレキサートの血
中濃度を上昇させ、中
毒症状(口内炎、汎血
球減少)が発現するお
それがある。
i
nv
i
t
r
o試験より本剤
は OAT3阻害作用を有
することが示唆されて
おり、メトトレキサー
トの尿中排出を遅延さ
せるおそれがある。
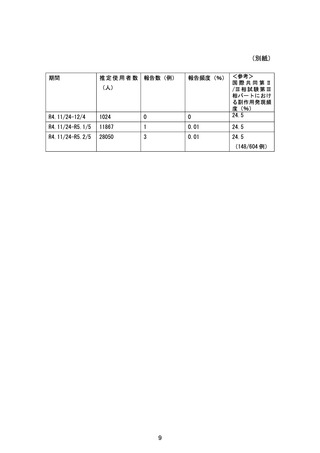
表 16-1 反復投与時の薬物動態パラメータ
投与日
例数
C
m
ax※1
(μg
/
mL
)
T
ma
x※2
(h
r
)
A
UC0-τ※1
(μg
・h
r/m
L)
T1/2※1
(h
r
)
1日目
8
22
.
3
(14
.8
)
2
.5
0
(1
.5
0
,8.0
0)
3
7
2.
9
(1
2.
0
)
-
5日目
7
28
.
1
(15
.
6
)
2
.
0
0
(1
.0
0
,8.0
0)
5
1
8.
3
(
1
3.
0)
51
.
4
(19
.
0
)
11
.副作用
次の副作用があらわれることがあるので、観察を十分に行い、異
常が認められた場合には投与を中止するなど適切な処置を行うこ
と。
11.2その他の副作用
種類\頻度
5
%
以上
1
〜5%未満
1%未満
過敏症
発疹
消化器
悪心、嘔吐、下
痢、腹部不快感
精神神経系
代謝
その他
※1:幾何平均値(%変動係数)
※2:中央値(最小値、最大値)
頻度不明
16.2吸収
そう痒
16.2.1食事の影響
健康成人 14例に本剤(エンシトレルビルとして 375mg)を空腹
頭痛
時又は高脂肪・高カロリー食摂取後に単回経口投与注したときの
脂質異常症
薬物動態パラメータ 3)を表 16-2に示す。
HDLコ レ ス テ トリグリセリド 血清鉄上昇
ロ ー ル 低 下 上昇、ビリルビ
(1
6
.
6
%)
ン上昇、血中コ
レステロール低
下
表1
6-2 375mg単回投与時注の薬物動態パラメータ
14
.適用上の注意
14.1薬剤交付時の注意
食事
条件
例数
Cm
ax※1
(μg
/
mL
)
Tm
a
x※2
(h
r
)
A
UC0-inf※1
(μg
・h
r/m
L)
空腹時
13
21
.4
(
2
3.
5
)
2.
5
0
(
1.5
0,4
.
00
)
123
6
(
23.
2)
食後※3
14
20
.0
(
16
.4)
6.
00
(1
.
50
,1
6.
00)
1
5
38
(1
5
.8)
※1:幾何平均値(%変動係数)
※2:中央値(最小値、最大値)
※3:高脂肪・高カロリー食
PTP包装の薬剤は PTPシートから取り出して服用するよう指導す
ること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入
し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発する
16.3分布
ことがある。
エンシトレルビルのヒト血清蛋白結合率は、97.7〜98.7%であっ
た 4)(i
nv
i
t
r
o)。
15
.その他の注意
16.4代謝
15.2非臨床試験に基づく情報
カニクイザルに本薬を 2又は 4週間反復経口投与した毒性試験に
健康成人にエンシトレルビル
おいて、臨床曝露量の 8倍相当以上で、肝臓門脈、胆嚢、肺/気
与注したとき、血漿中では主に未変化のエンシトレルビルが検出
フマル酸(懸濁剤)を単回経口投
管支等に単核細胞主体の炎症性細胞浸潤が認められている 1)。
され、代謝物としてエンシトレルビルのクロル付加体が検出され
た。尿中では主に未変化のエンシトレルビルが検出され、代謝物
16
.薬物動態
としてエンシトレルビルのトリアゾール脱メチル体が検出され
16.1血中濃度
た 5)。
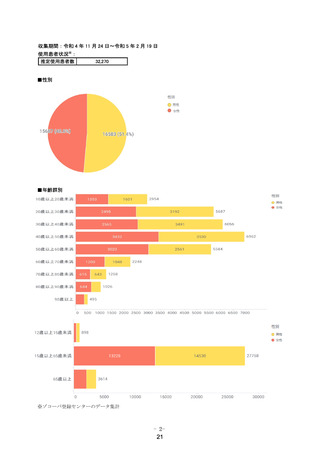
健康成人女性 8例に本剤を 5日間空腹時反復経口投与した(エン
また、i
nv
i
t
r
o代謝試験の結果、尿中の代謝物であるエンシトレ
シ ト レ ル ビ ル と し て 1日 目 は 375mg、 2日 目 か ら 5日 目 は
ルビルのトリアゾール脱メチル体は、CYP3Aを含む複数の CYP分
125mg)ときの血漿中濃度推移を図 16-1に、薬物動態パラメー
子種により生成されると推定された 6)。
タ 2)を表 16-1に示す。
16.5排泄
健康成人男性 20例にエンシトレルビル
フマル酸(懸濁剤)を
エンシトレルビルとして 250〜1000mgで空腹時単回経口投与注し
たときの、投与後 144時間までの尿中排泄率は 16.0〜21.8%で
あった 5)。
16.7薬物相互作用
16.7.1I
nv
i
t
r
o試験
エンシトレルビルは CYP3Aを時間依存的に阻害し、CYP2B6及び
CYP3Aを誘導する。
また、エンシトレルビルは P糖蛋白質(P-gp)及び乳がん耐性蛋
(4)
33
薬剤名等
ボセンタン水和物
臨床症状・措置方法
機序・危険因子
本剤の血中濃度が減少
し、作用が減弱するお
それがある。また、ボ
センタン水和物の血中
濃度が上昇し、副作用
が発現しやすくなるお
それがある。
ボセンタン水和物の
CYP3A誘 導 作 用 に よ
り、本剤の代謝が促進
されるおそれがある。
また、本剤の C
YP3Aに
対する阻害作用によ
り、ボセンタン水和物
の代謝が阻害される。
中程度の CY
P3
A誘導剤
本剤の血中濃度が減少 これらの薬剤の CYP3A
エファビレンツ、エト し、作用が減弱するお 誘導作用により、本剤
ラビリン、フェノバル それがある。
の代謝が促進されるお
ビタール、プリミドン
それがある。
等
メトトレキサート
メトトレキサートの血
中濃度を上昇させ、中
毒症状(口内炎、汎血
球減少)が発現するお
それがある。
i
nv
i
t
r
o試験より本剤
は OAT3阻害作用を有
することが示唆されて
おり、メトトレキサー
トの尿中排出を遅延さ
せるおそれがある。
表 16-1 反復投与時の薬物動態パラメータ
投与日
例数
C
m
ax※1
(μg
/
mL
)
T
ma
x※2
(h
r
)
A
UC0-τ※1
(μg
・h
r/m
L)
T1/2※1
(h
r
)
1日目
8
22
.
3
(14
.8
)
2
.5
0
(1
.5
0
,8.0
0)
3
7
2.
9
(1
2.
0
)
-
5日目
7
28
.
1
(15
.
6
)
2
.
0
0
(1
.0
0
,8.0
0)
5
1
8.
3
(
1
3.
0)
51
.
4
(19
.
0
)
11
.副作用
次の副作用があらわれることがあるので、観察を十分に行い、異
常が認められた場合には投与を中止するなど適切な処置を行うこ
と。
11.2その他の副作用
種類\頻度
5
%
以上
1
〜5%未満
1%未満
過敏症
発疹
消化器
悪心、嘔吐、下
痢、腹部不快感
精神神経系
代謝
その他
※1:幾何平均値(%変動係数)
※2:中央値(最小値、最大値)
頻度不明
16.2吸収
そう痒
16.2.1食事の影響
健康成人 14例に本剤(エンシトレルビルとして 375mg)を空腹
頭痛
時又は高脂肪・高カロリー食摂取後に単回経口投与注したときの
脂質異常症
薬物動態パラメータ 3)を表 16-2に示す。
HDLコ レ ス テ トリグリセリド 血清鉄上昇
ロ ー ル 低 下 上昇、ビリルビ
(1
6
.
6
%)
ン上昇、血中コ
レステロール低
下
表1
6-2 375mg単回投与時注の薬物動態パラメータ
14
.適用上の注意
14.1薬剤交付時の注意
食事
条件
例数
Cm
ax※1
(μg
/
mL
)
Tm
a
x※2
(h
r
)
A
UC0-inf※1
(μg
・h
r/m
L)
空腹時
13
21
.4
(
2
3.
5
)
2.
5
0
(
1.5
0,4
.
00
)
123
6
(
23.
2)
食後※3
14
20
.0
(
16
.4)
6.
00
(1
.
50
,1
6.
00)
1
5
38
(1
5
.8)
※1:幾何平均値(%変動係数)
※2:中央値(最小値、最大値)
※3:高脂肪・高カロリー食
PTP包装の薬剤は PTPシートから取り出して服用するよう指導す
ること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入
し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発する
16.3分布
ことがある。
エンシトレルビルのヒト血清蛋白結合率は、97.7〜98.7%であっ
た 4)(i
nv
i
t
r
o)。
15
.その他の注意
16.4代謝
15.2非臨床試験に基づく情報
カニクイザルに本薬を 2又は 4週間反復経口投与した毒性試験に
健康成人にエンシトレルビル
おいて、臨床曝露量の 8倍相当以上で、肝臓門脈、胆嚢、肺/気
与注したとき、血漿中では主に未変化のエンシトレルビルが検出
フマル酸(懸濁剤)を単回経口投
管支等に単核細胞主体の炎症性細胞浸潤が認められている 1)。
され、代謝物としてエンシトレルビルのクロル付加体が検出され
た。尿中では主に未変化のエンシトレルビルが検出され、代謝物
16
.薬物動態
としてエンシトレルビルのトリアゾール脱メチル体が検出され
16.1血中濃度
た 5)。
健康成人女性 8例に本剤を 5日間空腹時反復経口投与した(エン
また、i
nv
i
t
r
o代謝試験の結果、尿中の代謝物であるエンシトレ
シ ト レ ル ビ ル と し て 1日 目 は 375mg、 2日 目 か ら 5日 目 は
ルビルのトリアゾール脱メチル体は、CYP3Aを含む複数の CYP分
125mg)ときの血漿中濃度推移を図 16-1に、薬物動態パラメー
子種により生成されると推定された 6)。
タ 2)を表 16-1に示す。
16.5排泄
健康成人男性 20例にエンシトレルビル
フマル酸(懸濁剤)を
エンシトレルビルとして 250〜1000mgで空腹時単回経口投与注し
たときの、投与後 144時間までの尿中排泄率は 16.0〜21.8%で
あった 5)。
16.7薬物相互作用
16.7.1I
nv
i
t
r
o試験
エンシトレルビルは CYP3Aを時間依存的に阻害し、CYP2B6及び
CYP3Aを誘導する。
また、エンシトレルビルは P糖蛋白質(P-gp)及び乳がん耐性蛋
(4)
33