よむ、つかう、まなぶ。
資料2-5 緊急承認された医薬品の市販後安全対策について (35 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31510.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第4回 3/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ゾコーバ錠(6)
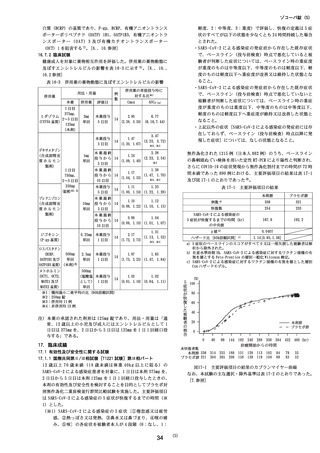
表 17-2 主な選択・除外基準
例で本薬投与前に認められたアミノ酸残基とアミノ酸変異の混在
(A94A/V、L272L/P、T45T/S、M130M/V、K100K/Stopと M130M/I、
選択 1.
12歳以上 1
8歳未満かつ体重 4
0kg以上又は 18歳以上 7
0歳未満
基準 2.SARS-CoV-2陽性(無作為化前 120時間以内に採取された検体を用
いた PC
R検査等により確認)
3.SARS-CoV-2による感染症の症状(14症状 a)のうち 1つ以上)発
現が無作為化前 120時間以内
4.無作為化時点において、SARS-CoV-2による感染症の症状(12症
状)b)のうち、中等度(スコア 2) c)以上の症状が 1つ以上認め
られる。ただし、SARS-CoV-2による感染症の発症前から存在した
症状である場合は、SARS-CoV-2による感染症により悪化したと被
験者が判断した症状に限る
5.治験薬投与開始〜投与終了後少なくとも 1
0日間避妊が可能な者
6.(女性のみ)妊婦ではなく、妊娠している可能性もない者
D263D/E:各 1例)が認められた。
18.3.2非臨床試験
SARS-CoV-2臨床分離株を用いた i
nv
i
t
r
o耐性発現試験において、
4代継代した結果、SARS-CoV-23CLプロテアーゼ領域に単一のア
ミノ酸変異(D48G、M49L、P52S及び S144A)及び複数のアミノ酸
変異(M
49L/S144A)を有する株が認められた 13)。
D48G、M49L、P52S又は S144Aを導入した組換え SARS-CoV-2は、
エンシトレルビルに対して 3.7〜17倍の感受性低下を示し、M49L
/S144Aを導入した組換え SARS-CoV-2は、エンシトレルビルに対
して 100倍の感受性低下を示した 14)。国際共同第Ⅱ/Ⅲ相試験
除外 1.S
p
O
3
%
以下(室内気)
2が 9
基準 2.
酸素投与を要する
3.
人工呼吸器を要する
4.中等度以上(CTCAE第 5.0版 Grade2以上)の肝疾患の現病歴又
は慢性病歴を有する
5.中等度以上(CTCAE第 5.0版 Grade2以上)の腎疾患の現病歴又
は慢性病歴を有する
(T1221試験)第Ⅱa相パートにおいて認められたアミノ酸変異
である A234S、L87F、H246Y、又は T198Iを導入した組換え SARSCoV-2は、エンシトレルビルに対して感受性変化を示さなかっ
た 15)。
19.有効成分に関する理化学的知見
a)①倦怠感又は疲労感、②筋肉痛又は体の痛み、③頭痛、④悪寒又は発
汗、⑤熱っぽさ又は発熱、⑥鼻水又は鼻づまり、⑦喉の痛み、⑧咳、
⑨息切れ(呼吸困難)、⑩吐き気、⑪嘔吐、⑫下痢、⑬味覚異常、⑭嗅
覚異常
b)①倦怠感(疲労感)、②筋肉痛又は体の痛み、③頭痛、④悪寒又は発
汗、⑤熱っぽさ又は発熱、⑥鼻水又は鼻づまり、⑦喉の痛み、⑧咳、
⑨息切れ(呼吸困難)
、⑩吐き気、⑪嘔吐、⑫下痢
c)症状のスコアを被験者本人が 4段階(0:なし、1:軽度、2:中等度、
3
:重度)で評価
一般的名称:エンシトレルビル
フマル酸
(EnsitrelvirFumaricAcid)(JAN)
化学名:(6E)-6-[(6-Chloro-2-methyl-2H-indazol-5-yl)
imino]-3-[(1-methyl-1H-1,2,4-triazol-3-yl)
m
ethyl]-1-[(2,4,5-trifluorophenyl)methyl]-1,3,5
t
riazinane-2,4-dionemonofumaricacid
分子式:C
H17ClF3N9O2・C4H4O4
2
2
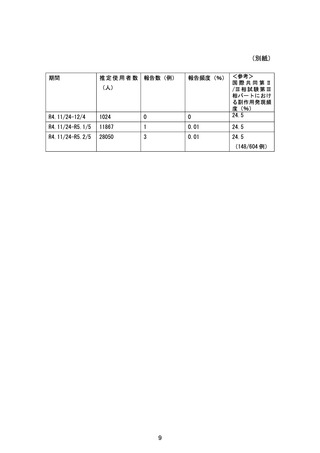
副作用発現頻度は、24.5%(148/604例)であり、主な副作用は、
分子量:647.95
高比重リポ蛋白減少 18.4%(111/604例)であった 9)。
性状:白色の粉末である。
化学構造式:
1
8.薬効薬理
18.1作用機序
エンシトレルビルは SARS-CoV-23CLプロテアーゼを阻害し、ポ
リタンパク質の切断を阻止することで、ウイルスの複製を抑制す
る 10)。
18.
2薬理作用
18.
2.
1I
nv
i
t
r
oウイルス増殖抑制効果
融点:245.2℃
エンシトレルビルは細胞培養系を用いた試験において、SARSCoV-2臨床分離株〔従来株(A系統)、alpha株(B.1.1.7系統)、
21.承認条件
beta株 ( B.1.351系 統 )、 gamma株 ( P.1系 統 )、 delta株
21.1医薬品リスク管理計画を策定の上、適切に実施すること。
(B.1.617.2系統)、theta株(P.3系統)、lambda株(C.37系
21.2本剤の投与が適切と判断される症例のみを対象に、あらかじ
統)、mu株(B.1.621系統)及び omicron株(B.1.1.529/BA.1、
め患者又は代諾者に有効性及び安全性に関する情報が文書をもっ
BA.1.1、BA.2、BA.2.75、BA.4、BA.5及び XE系統)〕に対して抗
て説明され、文書による同意を得てから初めて投与されるよう、
ウイルス活性を示し、50%有効濃度(EC50値)は、VeroE6/
医師に対して要請すること。
TMPRSS2細胞で 0.22〜0.52μmol/L、HEK293T/ACE2-TMPRSS2細胞
21.3国際共同第Ⅱ/Ⅲ相試験(T1221試験)の第Ⅲ相パートから適
で 0.026〜0.064μmol/Lであった。初代ヒト鼻腔由来細胞のヒト
切に有効性が確認された試験成績を取りまとめ速やかに提出する
気道上皮 3次元器官培養モデルを用いた細胞培養系において、
こと。
SARS-CoV-2臨床分離株〔delta株(B.1.617.2系統)〕に対する
22.包装
EC
.117μmol/Lであった 11)。
90は 0
28錠[14錠(PTP)×2
]
18.2.2I
nv
i
v
o抗ウイルス作用
SARS-CoV-2臨床分離株を接種した感染マウスにおいて、エンシ
23.主要文献
トレルビルは、ウイルス接種直後からの投与及びウイルス接種
〔文献請求番号〕
24時間後からの投与のいずれの場合でも、肺組織内ウイルス力
1)社内資料:エンシトレルビルのラット及びサルの反復投与毒性
価を用量依存的に減少させた。また、SARS-CoV-2マウス馴化株
試験(2022/11/22承認、申請資料概要 2.6.6.3)〔202200224〕
を接種したマウス致死モデルにおいて、溶媒群と比較してエンシ
2)社内資料:エンシトレルビルの健康成人対象第Ⅰ相試験(薬物
トレルビル群で生存率の改善、生存期間の延長及び体重減少の抑
動態・安全性)(2022/11/22承認、申請資料概要 2.5.3.1.1)
制が認められた 12)。
〔202200225〕
18.3耐性
3)社内資料:エンシトレルビルの健康成人対象第Ⅰ相試験(食事
18.3.1臨床試験
の 影 響 )( 2022/11/22承 認 、 申 請 資 料 概 要 2.5.2.3)
国際共同第Ⅱ/Ⅲ相試験(T1221試験)第Ⅱa相パートにおいて、
〔202200226〕
ベースライン前後の塩基配列解析が可能であった本薬群の被験者
4)社内資料:[14C]-エンシトレルビルの i
nv
i
t
r
o血清中タンパク結
34例のうち、10例で本薬投与後に SARS-CoV-23CLプロテアーゼ
合 試 験 ( 2022/11/22承 認 、 申 請 資 料 概 要 2.6.4.4.1.1)
領域にアミノ酸変異が認められた。そのうち、4例で 1種のアミ
〔202200227〕
ノ酸変異(A234S、L87F、H246Y、T198I:各 1例)が認められ、6
5)社内資料:エンシトレルビルの健康成人対象第Ⅰ相試験(単回
(6)
35
表 17-2 主な選択・除外基準
例で本薬投与前に認められたアミノ酸残基とアミノ酸変異の混在
(A94A/V、L272L/P、T45T/S、M130M/V、K100K/Stopと M130M/I、
選択 1.
12歳以上 1
8歳未満かつ体重 4
0kg以上又は 18歳以上 7
0歳未満
基準 2.SARS-CoV-2陽性(無作為化前 120時間以内に採取された検体を用
いた PC
R検査等により確認)
3.SARS-CoV-2による感染症の症状(14症状 a)のうち 1つ以上)発
現が無作為化前 120時間以内
4.無作為化時点において、SARS-CoV-2による感染症の症状(12症
状)b)のうち、中等度(スコア 2) c)以上の症状が 1つ以上認め
られる。ただし、SARS-CoV-2による感染症の発症前から存在した
症状である場合は、SARS-CoV-2による感染症により悪化したと被
験者が判断した症状に限る
5.治験薬投与開始〜投与終了後少なくとも 1
0日間避妊が可能な者
6.(女性のみ)妊婦ではなく、妊娠している可能性もない者
D263D/E:各 1例)が認められた。
18.3.2非臨床試験
SARS-CoV-2臨床分離株を用いた i
nv
i
t
r
o耐性発現試験において、
4代継代した結果、SARS-CoV-23CLプロテアーゼ領域に単一のア
ミノ酸変異(D48G、M49L、P52S及び S144A)及び複数のアミノ酸
変異(M
49L/S144A)を有する株が認められた 13)。
D48G、M49L、P52S又は S144Aを導入した組換え SARS-CoV-2は、
エンシトレルビルに対して 3.7〜17倍の感受性低下を示し、M49L
/S144Aを導入した組換え SARS-CoV-2は、エンシトレルビルに対
して 100倍の感受性低下を示した 14)。国際共同第Ⅱ/Ⅲ相試験
除外 1.S
p
O
3
%
以下(室内気)
2が 9
基準 2.
酸素投与を要する
3.
人工呼吸器を要する
4.中等度以上(CTCAE第 5.0版 Grade2以上)の肝疾患の現病歴又
は慢性病歴を有する
5.中等度以上(CTCAE第 5.0版 Grade2以上)の腎疾患の現病歴又
は慢性病歴を有する
(T1221試験)第Ⅱa相パートにおいて認められたアミノ酸変異
である A234S、L87F、H246Y、又は T198Iを導入した組換え SARSCoV-2は、エンシトレルビルに対して感受性変化を示さなかっ
た 15)。
19.有効成分に関する理化学的知見
a)①倦怠感又は疲労感、②筋肉痛又は体の痛み、③頭痛、④悪寒又は発
汗、⑤熱っぽさ又は発熱、⑥鼻水又は鼻づまり、⑦喉の痛み、⑧咳、
⑨息切れ(呼吸困難)、⑩吐き気、⑪嘔吐、⑫下痢、⑬味覚異常、⑭嗅
覚異常
b)①倦怠感(疲労感)、②筋肉痛又は体の痛み、③頭痛、④悪寒又は発
汗、⑤熱っぽさ又は発熱、⑥鼻水又は鼻づまり、⑦喉の痛み、⑧咳、
⑨息切れ(呼吸困難)
、⑩吐き気、⑪嘔吐、⑫下痢
c)症状のスコアを被験者本人が 4段階(0:なし、1:軽度、2:中等度、
3
:重度)で評価
一般的名称:エンシトレルビル
フマル酸
(EnsitrelvirFumaricAcid)(JAN)
化学名:(6E)-6-[(6-Chloro-2-methyl-2H-indazol-5-yl)
imino]-3-[(1-methyl-1H-1,2,4-triazol-3-yl)
m
ethyl]-1-[(2,4,5-trifluorophenyl)methyl]-1,3,5
t
riazinane-2,4-dionemonofumaricacid
分子式:C
H17ClF3N9O2・C4H4O4
2
2
副作用発現頻度は、24.5%(148/604例)であり、主な副作用は、
分子量:647.95
高比重リポ蛋白減少 18.4%(111/604例)であった 9)。
性状:白色の粉末である。
化学構造式:
1
8.薬効薬理
18.1作用機序
エンシトレルビルは SARS-CoV-23CLプロテアーゼを阻害し、ポ
リタンパク質の切断を阻止することで、ウイルスの複製を抑制す
る 10)。
18.
2薬理作用
18.
2.
1I
nv
i
t
r
oウイルス増殖抑制効果
融点:245.2℃
エンシトレルビルは細胞培養系を用いた試験において、SARSCoV-2臨床分離株〔従来株(A系統)、alpha株(B.1.1.7系統)、
21.承認条件
beta株 ( B.1.351系 統 )、 gamma株 ( P.1系 統 )、 delta株
21.1医薬品リスク管理計画を策定の上、適切に実施すること。
(B.1.617.2系統)、theta株(P.3系統)、lambda株(C.37系
21.2本剤の投与が適切と判断される症例のみを対象に、あらかじ
統)、mu株(B.1.621系統)及び omicron株(B.1.1.529/BA.1、
め患者又は代諾者に有効性及び安全性に関する情報が文書をもっ
BA.1.1、BA.2、BA.2.75、BA.4、BA.5及び XE系統)〕に対して抗
て説明され、文書による同意を得てから初めて投与されるよう、
ウイルス活性を示し、50%有効濃度(EC50値)は、VeroE6/
医師に対して要請すること。
TMPRSS2細胞で 0.22〜0.52μmol/L、HEK293T/ACE2-TMPRSS2細胞
21.3国際共同第Ⅱ/Ⅲ相試験(T1221試験)の第Ⅲ相パートから適
で 0.026〜0.064μmol/Lであった。初代ヒト鼻腔由来細胞のヒト
切に有効性が確認された試験成績を取りまとめ速やかに提出する
気道上皮 3次元器官培養モデルを用いた細胞培養系において、
こと。
SARS-CoV-2臨床分離株〔delta株(B.1.617.2系統)〕に対する
22.包装
EC
.117μmol/Lであった 11)。
90は 0
28錠[14錠(PTP)×2
]
18.2.2I
nv
i
v
o抗ウイルス作用
SARS-CoV-2臨床分離株を接種した感染マウスにおいて、エンシ
23.主要文献
トレルビルは、ウイルス接種直後からの投与及びウイルス接種
〔文献請求番号〕
24時間後からの投与のいずれの場合でも、肺組織内ウイルス力
1)社内資料:エンシトレルビルのラット及びサルの反復投与毒性
価を用量依存的に減少させた。また、SARS-CoV-2マウス馴化株
試験(2022/11/22承認、申請資料概要 2.6.6.3)〔202200224〕
を接種したマウス致死モデルにおいて、溶媒群と比較してエンシ
2)社内資料:エンシトレルビルの健康成人対象第Ⅰ相試験(薬物
トレルビル群で生存率の改善、生存期間の延長及び体重減少の抑
動態・安全性)(2022/11/22承認、申請資料概要 2.5.3.1.1)
制が認められた 12)。
〔202200225〕
18.3耐性
3)社内資料:エンシトレルビルの健康成人対象第Ⅰ相試験(食事
18.3.1臨床試験
の 影 響 )( 2022/11/22承 認 、 申 請 資 料 概 要 2.5.2.3)
国際共同第Ⅱ/Ⅲ相試験(T1221試験)第Ⅱa相パートにおいて、
〔202200226〕
ベースライン前後の塩基配列解析が可能であった本薬群の被験者
4)社内資料:[14C]-エンシトレルビルの i
nv
i
t
r
o血清中タンパク結
34例のうち、10例で本薬投与後に SARS-CoV-23CLプロテアーゼ
合 試 験 ( 2022/11/22承 認 、 申 請 資 料 概 要 2.6.4.4.1.1)
領域にアミノ酸変異が認められた。そのうち、4例で 1種のアミ
〔202200227〕
ノ酸変異(A234S、L87F、H246Y、T198I:各 1例)が認められ、6
5)社内資料:エンシトレルビルの健康成人対象第Ⅰ相試験(単回
(6)
35