よむ、つかう、まなぶ。
資料2-5 緊急承認された医薬品の市販後安全対策について (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31510.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第4回 3/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ゾコーバ錠(5)
白質(BCRP)の基質であり、P-gp、BCRP、有機アニオントランス
軽度、2:中等度、3:重度)で評価し、快復の定義は 5症
ポーターポリペプチド(OATP)1B1、OATP1B3、有機アニオントラ
状のすべてが以下の状態を少なくとも 24時間持続した場合
ン ス ポ ー タ ー ( OAT) 3及 び 有 機 カ チ オ ン ト ラ ン ス ポ ー タ ー
とされた。
(OCT)1を阻害する
7
)
。[8.、10.参照]
・SARS-CoV-2による感染症の発症前から存在した既存症状
で、ベースライン(投与前検査)時点で悪化していると被
16.7.2臨床試験
健康成人を対象に薬物相互作用を評価した。併用薬の薬物動態に
験者が判断した症状については、ベースライン時の重症度
及ぼすエンシトレルビルの影響を表 16-3に示す 8)。[8.、10.、
が重度のものは中等度以下、中等度のものは軽度以下、軽
10.2参照]
度のものは軽度以下へ重症度が改善又は維持した状態とな
ること。
表 16-3 併用薬の薬物動態に及ぼすエンシトレルビルの影響
用法・用量
併用薬
本薬
1日目
37
5mg、
ミダゾラム
2〜5日目
(CYP3A基質)
125m
g
(本剤)
併用薬
評価日
併用薬の単独投与時に
対する比※1
C
max
で、ベースライン(投与前検査)時点で悪化していないと
被験者が判断した症状については、ベースライン時の重症
AU
C0-inf
度が重度のものは重度以下、中等度のものは中等度以下、
2
mg
単回
本薬投与
5日目
14
軽度のものは軽度以下へ重症度が維持又は改善した状態と
2.80
6.
7
7
(2.38,3.30) (
6.
16
,
7.4
4
)
なること。
・上記以外の症状[SARS-CoV-2による感染症の発症前には存
本薬投与
5日目
デキサメタゾン
(合成副腎皮
質ホルモン
製剤)
例
数
・SARS-CoV-2による感染症の発症前から存在した既存症状
在しておらず、ベースライン(投与前検査)時点以降に発
3.
4
7
1.47
(
3.
23
,3
.
72
)
14
(1.30,1.67)
※3
、※4
現した症状]については、なしの状態となること。
2.
3
8
本薬最終
1
mg
1.24
(
2.
23
,2
.
54
)
投 与 か ら 14
単回
(1.09,1.40)
※4
5日目
1日目
750
mg、
2
〜5日目
250mg
(錠剤)※2、注
プレドニゾロン
(合成副腎皮
質ホルモン
製剤)
の鼻咽頭ぬぐい検体を用いた定性 RT-PCRにより陽性と判断され、
さらに COVID-19の症状発現から無作為化割付までの時間が 72時
1.
5
8
本薬最終
1.17
(
1.
47
,1
.
70
)
投 与 か ら 14
(1.04,1.33)
※3
、※4
1
0日目
本薬投与
5日目
14
間未満であった 690例における、主要評価項目の結果は表 17-1
及び図 1
7-1のとおりであった 9)。
1.11
1.
2
5
(1.00,1.24) (
1.
22
,1
.
28
)
表 171 主要評価項目の結果
本剤群
プラセボ群
例数 a)
33
6
3
2
1
快復数
25
4
2
3
3
SA
R
SC
oV2による感染症の
5症状が快復するまでの時間(h
r
)
の中央値
167
.
9
1
9
2
.
2
本薬最終
1.10
1.
1
2
10mg 投 与 か ら 14
(0.99,1.22) (
1.
10
,1
.
15
)
単回
5日目
本薬最終
0.99
1.
0
4
投 与 か ら 14
(0.89,1.10) (
1.
01
,1
.
07
)
10日目
1.
3
1
2.17
(
1.
13
,1
.
52
)
(1.72,2.73)
※3
、※4
ジゴキシン
(P
-g
p基質)
0
.25mg 本薬投与
単回
1日目
14
ロスバスタチン
500mg
(BCRP、
単回
OATP1B1及び
注
OATP1B3基質) (
本剤)
2.5
mg 本薬投与
単回
1日目
14
1.97
1.
6
5
(1.73,2.25) (
1.
47
,1
.
84
)
500
mg
(塩酸塩 本薬投与
として) 1日目
単回
1
4
1.03
1.
0
2
(0.91,1.16) (
0.
94
,1
.
11
)
メトホルミン
(OCT1、OCT2、
MATE1及び
MATE2基質)
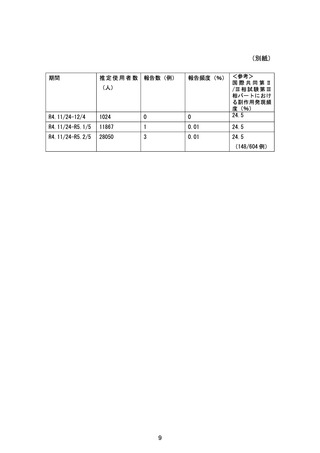
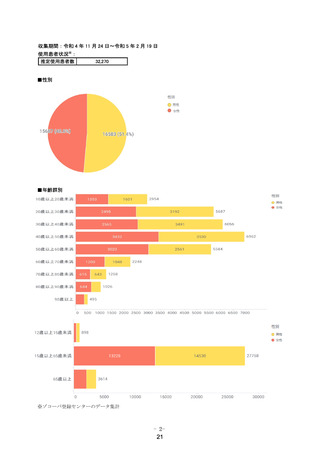
無作為化された 1215例(日本人 662例)のうち、ベースライン
p値 b)
0.
0
40
7
ハザード比[9
5%
信頼区間]c)
1.
1
4
[0.
9
5,
1.
3
6
]
a)5症状のベースラインのスコアがすべて 0又は一部欠測した被験者は解
析から除外された。
b)有意水準両側 5%、SARS-CoV-2による感染症に対するワクチン接種の有
無を層とする Pe
t
o-P
r
e
nt
ic
eの層別一般化 Wi
lco
x
o
n検定。
c)SARS-CoV-2による感染症に対するワクチン接種の有無を層とした層別
C
o
xハザードモデル。
※1
:幾何最小二乗平均の比(90
%信頼区間)
※2
:2
5
0
mg錠
※3
:併用時 1
1例
※4
:非併用時 1
3例
注)本薬の承認された剤形は 125mg錠であり、用法・用量は「通
常、12歳以上の小児及び成人にはエンシトレルビルとして 1
日目は 375mgを、2日目から 5日目は 125mgを 1日 1回経口投
与する」である。
1
7
.臨床成績
17.1有効性及び安全性に関する試験
17.1.1国際共同第Ⅱ/Ⅲ相試験[T1221試験]第Ⅲ相パート
12歳以上 70歳未満(18歳未満は体重 40kg以上に限る)の
SARS-CoV-2による感染症患者を対象に、1日目は本剤 375mgを、
なお、本試験の主な選択・除外基準は表 17-2のとおりであった。
2日目から 5日目は本剤 125mgを 1日 1回経口投与したときの、
[7.参照]
本剤の有効性及び安全性を検討することを目的としてプラセボ対
照無作為化二重盲検並行群間比較試験を実施した。主要評価項目
は SARS-CoV-2による感染症の 5症状が快復するまでの時間(※
1)とした。
(※1)SARS-CoV-2による感染症の 5症状〔①倦怠感又は疲労
感、②熱っぽさ又は発熱、③鼻水又は鼻づまり、④喉の痛
み、⑤咳〕の各症状を被験者本人が 4段階(0:なし、1:
34
(5)
白質(BCRP)の基質であり、P-gp、BCRP、有機アニオントランス
軽度、2:中等度、3:重度)で評価し、快復の定義は 5症
ポーターポリペプチド(OATP)1B1、OATP1B3、有機アニオントラ
状のすべてが以下の状態を少なくとも 24時間持続した場合
ン ス ポ ー タ ー ( OAT) 3及 び 有 機 カ チ オ ン ト ラ ン ス ポ ー タ ー
とされた。
(OCT)1を阻害する
7
)
。[8.、10.参照]
・SARS-CoV-2による感染症の発症前から存在した既存症状
で、ベースライン(投与前検査)時点で悪化していると被
16.7.2臨床試験
健康成人を対象に薬物相互作用を評価した。併用薬の薬物動態に
験者が判断した症状については、ベースライン時の重症度
及ぼすエンシトレルビルの影響を表 16-3に示す 8)。[8.、10.、
が重度のものは中等度以下、中等度のものは軽度以下、軽
10.2参照]
度のものは軽度以下へ重症度が改善又は維持した状態とな
ること。
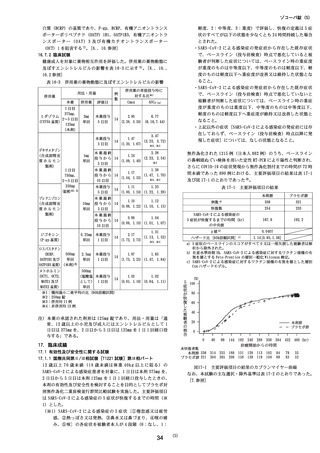
表 16-3 併用薬の薬物動態に及ぼすエンシトレルビルの影響
用法・用量
併用薬
本薬
1日目
37
5mg、
ミダゾラム
2〜5日目
(CYP3A基質)
125m
g
(本剤)
併用薬
評価日
併用薬の単独投与時に
対する比※1
C
max
で、ベースライン(投与前検査)時点で悪化していないと
被験者が判断した症状については、ベースライン時の重症
AU
C0-inf
度が重度のものは重度以下、中等度のものは中等度以下、
2
mg
単回
本薬投与
5日目
14
軽度のものは軽度以下へ重症度が維持又は改善した状態と
2.80
6.
7
7
(2.38,3.30) (
6.
16
,
7.4
4
)
なること。
・上記以外の症状[SARS-CoV-2による感染症の発症前には存
本薬投与
5日目
デキサメタゾン
(合成副腎皮
質ホルモン
製剤)
例
数
・SARS-CoV-2による感染症の発症前から存在した既存症状
在しておらず、ベースライン(投与前検査)時点以降に発
3.
4
7
1.47
(
3.
23
,3
.
72
)
14
(1.30,1.67)
※3
、※4
現した症状]については、なしの状態となること。
2.
3
8
本薬最終
1
mg
1.24
(
2.
23
,2
.
54
)
投 与 か ら 14
単回
(1.09,1.40)
※4
5日目
1日目
750
mg、
2
〜5日目
250mg
(錠剤)※2、注
プレドニゾロン
(合成副腎皮
質ホルモン
製剤)
の鼻咽頭ぬぐい検体を用いた定性 RT-PCRにより陽性と判断され、
さらに COVID-19の症状発現から無作為化割付までの時間が 72時
1.
5
8
本薬最終
1.17
(
1.
47
,1
.
70
)
投 与 か ら 14
(1.04,1.33)
※3
、※4
1
0日目
本薬投与
5日目
14
間未満であった 690例における、主要評価項目の結果は表 17-1
及び図 1
7-1のとおりであった 9)。
1.11
1.
2
5
(1.00,1.24) (
1.
22
,1
.
28
)
表 171 主要評価項目の結果
本剤群
プラセボ群
例数 a)
33
6
3
2
1
快復数
25
4
2
3
3
SA
R
SC
oV2による感染症の
5症状が快復するまでの時間(h
r
)
の中央値
167
.
9
1
9
2
.
2
本薬最終
1.10
1.
1
2
10mg 投 与 か ら 14
(0.99,1.22) (
1.
10
,1
.
15
)
単回
5日目
本薬最終
0.99
1.
0
4
投 与 か ら 14
(0.89,1.10) (
1.
01
,1
.
07
)
10日目
1.
3
1
2.17
(
1.
13
,1
.
52
)
(1.72,2.73)
※3
、※4
ジゴキシン
(P
-g
p基質)
0
.25mg 本薬投与
単回
1日目
14
ロスバスタチン
500mg
(BCRP、
単回
OATP1B1及び
注
OATP1B3基質) (
本剤)
2.5
mg 本薬投与
単回
1日目
14
1.97
1.
6
5
(1.73,2.25) (
1.
47
,1
.
84
)
500
mg
(塩酸塩 本薬投与
として) 1日目
単回
1
4
1.03
1.
0
2
(0.91,1.16) (
0.
94
,1
.
11
)
メトホルミン
(OCT1、OCT2、
MATE1及び
MATE2基質)
無作為化された 1215例(日本人 662例)のうち、ベースライン
p値 b)
0.
0
40
7
ハザード比[9
5%
信頼区間]c)
1.
1
4
[0.
9
5,
1.
3
6
]
a)5症状のベースラインのスコアがすべて 0又は一部欠測した被験者は解
析から除外された。
b)有意水準両側 5%、SARS-CoV-2による感染症に対するワクチン接種の有
無を層とする Pe
t
o-P
r
e
nt
ic
eの層別一般化 Wi
lco
x
o
n検定。
c)SARS-CoV-2による感染症に対するワクチン接種の有無を層とした層別
C
o
xハザードモデル。
※1
:幾何最小二乗平均の比(90
%信頼区間)
※2
:2
5
0
mg錠
※3
:併用時 1
1例
※4
:非併用時 1
3例
注)本薬の承認された剤形は 125mg錠であり、用法・用量は「通
常、12歳以上の小児及び成人にはエンシトレルビルとして 1
日目は 375mgを、2日目から 5日目は 125mgを 1日 1回経口投
与する」である。
1
7
.臨床成績
17.1有効性及び安全性に関する試験
17.1.1国際共同第Ⅱ/Ⅲ相試験[T1221試験]第Ⅲ相パート
12歳以上 70歳未満(18歳未満は体重 40kg以上に限る)の
SARS-CoV-2による感染症患者を対象に、1日目は本剤 375mgを、
なお、本試験の主な選択・除外基準は表 17-2のとおりであった。
2日目から 5日目は本剤 125mgを 1日 1回経口投与したときの、
[7.参照]
本剤の有効性及び安全性を検討することを目的としてプラセボ対
照無作為化二重盲検並行群間比較試験を実施した。主要評価項目
は SARS-CoV-2による感染症の 5症状が快復するまでの時間(※
1)とした。
(※1)SARS-CoV-2による感染症の 5症状〔①倦怠感又は疲労
感、②熱っぽさ又は発熱、③鼻水又は鼻づまり、④喉の痛
み、⑤咳〕の各症状を被験者本人が 4段階(0:なし、1:
34
(5)