よむ、つかう、まなぶ。
資料2-1 医薬品等の使用上の注意の改訂について [289KB] (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
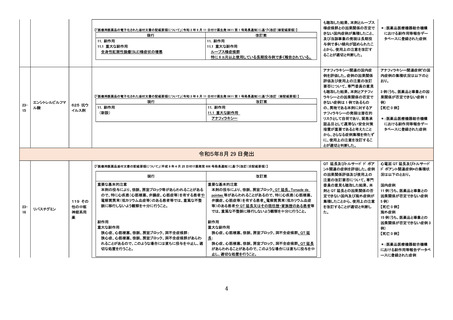
副作用(MedDRA SMQ「非感
染性脳炎(狭域)」に該当する
PT)発現後のみ当該抗体医
薬品の投与が確認された症
例は含む
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
2327
テトロホスミンテクネ
チウム(99mTc)
430 放
射性医薬
品
(新設)
11. 副作用
(新設)
改訂案
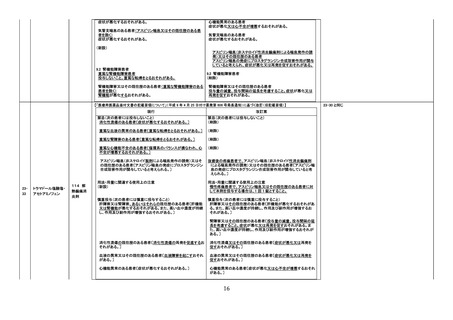
2. 禁忌(次の患者には投与しないこと)
本剤の成分に対し過敏症の既往歴のある患者
アナフィラキシー関連症例を評
価した。症例の因果関係評価及
び使用上の注意の改訂要否に
ついて、専門委員の意見も聴取
した結果、本剤とショック及びア
ナフィラキシーとの因果関係が
否定できない症例が集積したこ
とから、使用上の注意を改訂す
ることが適切と判断した。
アナフィラキシー関連症例*の集
積状況は以下のとおり。
国内症例
2 例(うち、医薬品と事象との因
果関係が否定できない症例 2
例)
【死亡 0 例】
海外症例
13 例(うち、医薬品と事象との
因果関係が否定できない症例
8 例)
【死亡 0 例】
11. 副作用
11.1 重大な副作用
ショック、アナフィラキシー
*:医薬品医療機器総合機構
における副作用等報告データベ
ースに登録された症例
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
2328
コロナウイルス
(SARS-CoV-2)ワク
チン(遺伝子組換え
サルアデノウイルス
ベクター)
631 ワク
チン類
改訂案
8. 重要な基本的注意
(新設)
8. 重要な基本的注意
本剤接種後に、免疫性血小板減少症が報告されているため、必要
に応じて血小板数の検査を行うこと。
9. 特定の背景を有する者に関する注意
9.1 接種要注意者(接種の判断を行うに際し、注意を要する者)
(新設)
9. 特定の背景を有する者に関する注意
9.1 接種要注意者(接種の判断を行うに際し、注意を要する者)
免疫性血小板減少症の既往歴のある者
血小板数のモニタリングを行うことが望ましい。
11. 副反応
11.1 重大な副反応
(新設)
11. 副反応
11.1 重大な副反応
免疫性血小板減少症
11
免疫性血小板減少症関連症例
を評価した。症例の因果関係評
価及び使用上の注意の改訂要
否について、専門委員の意見も
聴取した結果、本剤と免疫性血
小板減少症との因果関係の否定
できない症例が集積したことか
ら、使用上の注意を改訂すること
が適切と判断した。
免疫性血小板減少症関連症例*
の集積状況は以下のとおり。
国内症例
0例
†
海外症例
578 例 ‡
【死亡 11 例 §】
*:医薬品医療機器総合機構
における副作用等報告データ
ベースに登録された症例
†:企業が CCDS 改訂根拠とし
た症例
‡:企業により医薬品と事象との
関連性が高いと判断された症
例 3 例を評価し、いずれも因
果関係が否定できないと評価
した
§:評価した症例 3 例に死亡
例は含まれていない
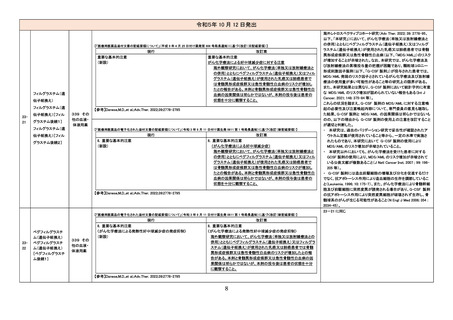
染性脳炎(狭域)」に該当する
PT)発現後のみ当該抗体医
薬品の投与が確認された症
例は含む
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
2327
テトロホスミンテクネ
チウム(99mTc)
430 放
射性医薬
品
(新設)
11. 副作用
(新設)
改訂案
2. 禁忌(次の患者には投与しないこと)
本剤の成分に対し過敏症の既往歴のある患者
アナフィラキシー関連症例を評
価した。症例の因果関係評価及
び使用上の注意の改訂要否に
ついて、専門委員の意見も聴取
した結果、本剤とショック及びア
ナフィラキシーとの因果関係が
否定できない症例が集積したこ
とから、使用上の注意を改訂す
ることが適切と判断した。
アナフィラキシー関連症例*の集
積状況は以下のとおり。
国内症例
2 例(うち、医薬品と事象との因
果関係が否定できない症例 2
例)
【死亡 0 例】
海外症例
13 例(うち、医薬品と事象との
因果関係が否定できない症例
8 例)
【死亡 0 例】
11. 副作用
11.1 重大な副作用
ショック、アナフィラキシー
*:医薬品医療機器総合機構
における副作用等報告データベ
ースに登録された症例
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
2328
コロナウイルス
(SARS-CoV-2)ワク
チン(遺伝子組換え
サルアデノウイルス
ベクター)
631 ワク
チン類
改訂案
8. 重要な基本的注意
(新設)
8. 重要な基本的注意
本剤接種後に、免疫性血小板減少症が報告されているため、必要
に応じて血小板数の検査を行うこと。
9. 特定の背景を有する者に関する注意
9.1 接種要注意者(接種の判断を行うに際し、注意を要する者)
(新設)
9. 特定の背景を有する者に関する注意
9.1 接種要注意者(接種の判断を行うに際し、注意を要する者)
免疫性血小板減少症の既往歴のある者
血小板数のモニタリングを行うことが望ましい。
11. 副反応
11.1 重大な副反応
(新設)
11. 副反応
11.1 重大な副反応
免疫性血小板減少症
11
免疫性血小板減少症関連症例
を評価した。症例の因果関係評
価及び使用上の注意の改訂要
否について、専門委員の意見も
聴取した結果、本剤と免疫性血
小板減少症との因果関係の否定
できない症例が集積したことか
ら、使用上の注意を改訂すること
が適切と判断した。
免疫性血小板減少症関連症例*
の集積状況は以下のとおり。
国内症例
0例
†
海外症例
578 例 ‡
【死亡 11 例 §】
*:医薬品医療機器総合機構
における副作用等報告データ
ベースに登録された症例
†:企業が CCDS 改訂根拠とし
た症例
‡:企業により医薬品と事象との
関連性が高いと判断された症
例 3 例を評価し、いずれも因
果関係が否定できないと評価
した
§:評価した症例 3 例に死亡
例は含まれていない