よむ、つかう、まなぶ。
資料2-1 医薬品等の使用上の注意の改訂について [289KB] (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
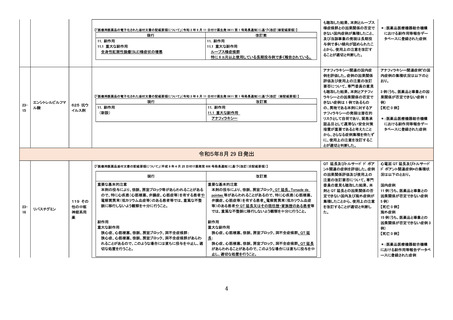
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂(旧記載要領)】
現行
副作用
重大な副作用
(新設)
2337
ワルファリンカリウム
333 血
液凝固阻
止剤
23-36 と同じ
改訂案
副作用
重大な副作用
急性腎障害:
経口抗凝固薬の投与後に急性腎障害があらわれることがある。
本剤投与後の急性腎障害の中には、血尿や治療域を超える INR
を認めるもの、腎生検により尿細管内に赤血球円柱を多数認め
るものが報告されている。
【参考】Brodsky,S.,et al.:J.Am.Soc.Nephrol. 2018;29:2787-2793
Zakrocka,I.,et al.:Adv.Clin.Exp.Med. 2022;31:165-173
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
改訂案
11. 副作用
11.1 重大な副作用
(新設)
11. 副作用
11.1 重大な副作用
急性腎障害
経口抗凝固薬の投与後に急性腎障害があらわれることがある。
本剤投与後の急性腎障害の中には、血尿や治療域を超える INR
を認めるもの、腎生検により尿細管内に赤血球円柱を多数認め
るものが報告されている。
【参考】Brodsky,S.,et al.:J.Am.Soc.Nephrol. 2018;29:2787-2793
Zakrocka,I.,et al.:Adv.Clin.Exp.Med. 2022;31:165-173
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
2338
ガラクトシル人血清
アルブミンジエチレン
トリアミン五酢酸テク
ネチウム(99mTc)
430 放
射性医薬
品
改訂案
(新設)
2. 禁忌(次の患者には投与しないこと)
本剤の成分に対し過敏症の既往歴のある患者
11. 副作用
(新設)
11. 副作用
11.1 重大な副作用
ショック、アナフィラキシー
アナフィラキシー関連症例を評
価した。症例の因果関係評価及
び使用上の注意の改訂要否に
ついて、専門委員の意見も聴取
した結果、本剤とショック及びア
ナフィラキシーとの因果関係の
否定できない症例が集積したこ
とから、使用上の注意を改訂す
ることが適切と判断した。
アナフィラキシー関連症例*の国
内症例の集積状況
医薬品の品質、有効性及び安全
性に関する情報の収集、調査、
検討等を踏まえ、医薬品の「使
用上の注意」の改訂が必要と考
えた。
-
4 例(うち、医薬品と事象との因
果関係が否定できない症例 4
例)
【死亡 0 例】
*:医薬品医療機器総合機構に
おける副作用等報告データベ
ースに登録された症例
令和5年 11 月 24 日発出
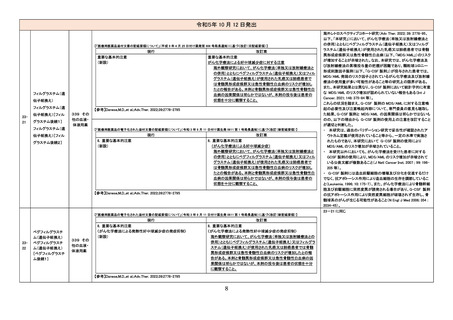
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
2339
ニボルマブ(遺伝子
組換え)
429 その
他の腫瘍
用薬
現行
改訂案
7. 用法及び用量に関連する注意
〈切除不能な進行・再発の非小細胞肺癌〉
他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍は、
「17.臨床成績」の項の内容を熟知し、臨床試験において検討された
患者の PD-L1 発現率を考慮した上で選択すること。
7. 用法及び用量に関連する注意
〈切除不能な進行・再発の非小細胞肺癌〉
他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍は、
「17.臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等
を参考にした上で、臨床試験において検討された患者の PD-L1 発
現率を考慮した上で選択すること。
〈非小細胞肺癌における術前補助療法〉
併用する他の抗悪性腫瘍剤は、「17.臨床成績」の項の内容を熟知し
選択すること。
〈非小細胞肺癌における術前補助療法〉
併用する他の抗悪性腫瘍剤は、「17.臨床成績」の項の内容を熟知
し、国内外の最新のガイドライン等を参考にした上で、選択する
こと。
〈治癒切除不能な進行・再発の胃癌〉
〈治癒切除不能な進行・再発の胃癌〉
21
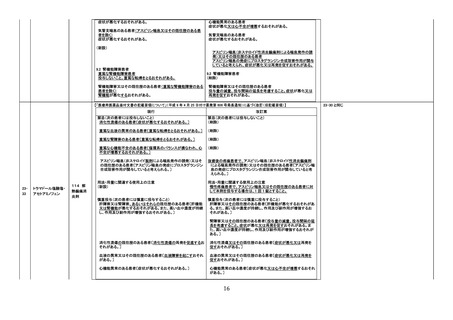
現行
副作用
重大な副作用
(新設)
2337
ワルファリンカリウム
333 血
液凝固阻
止剤
23-36 と同じ
改訂案
副作用
重大な副作用
急性腎障害:
経口抗凝固薬の投与後に急性腎障害があらわれることがある。
本剤投与後の急性腎障害の中には、血尿や治療域を超える INR
を認めるもの、腎生検により尿細管内に赤血球円柱を多数認め
るものが報告されている。
【参考】Brodsky,S.,et al.:J.Am.Soc.Nephrol. 2018;29:2787-2793
Zakrocka,I.,et al.:Adv.Clin.Exp.Med. 2022;31:165-173
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
改訂案
11. 副作用
11.1 重大な副作用
(新設)
11. 副作用
11.1 重大な副作用
急性腎障害
経口抗凝固薬の投与後に急性腎障害があらわれることがある。
本剤投与後の急性腎障害の中には、血尿や治療域を超える INR
を認めるもの、腎生検により尿細管内に赤血球円柱を多数認め
るものが報告されている。
【参考】Brodsky,S.,et al.:J.Am.Soc.Nephrol. 2018;29:2787-2793
Zakrocka,I.,et al.:Adv.Clin.Exp.Med. 2022;31:165-173
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
2338
ガラクトシル人血清
アルブミンジエチレン
トリアミン五酢酸テク
ネチウム(99mTc)
430 放
射性医薬
品
改訂案
(新設)
2. 禁忌(次の患者には投与しないこと)
本剤の成分に対し過敏症の既往歴のある患者
11. 副作用
(新設)
11. 副作用
11.1 重大な副作用
ショック、アナフィラキシー
アナフィラキシー関連症例を評
価した。症例の因果関係評価及
び使用上の注意の改訂要否に
ついて、専門委員の意見も聴取
した結果、本剤とショック及びア
ナフィラキシーとの因果関係の
否定できない症例が集積したこ
とから、使用上の注意を改訂す
ることが適切と判断した。
アナフィラキシー関連症例*の国
内症例の集積状況
医薬品の品質、有効性及び安全
性に関する情報の収集、調査、
検討等を踏まえ、医薬品の「使
用上の注意」の改訂が必要と考
えた。
-
4 例(うち、医薬品と事象との因
果関係が否定できない症例 4
例)
【死亡 0 例】
*:医薬品医療機器総合機構に
おける副作用等報告データベ
ースに登録された症例
令和5年 11 月 24 日発出
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
2339
ニボルマブ(遺伝子
組換え)
429 その
他の腫瘍
用薬
現行
改訂案
7. 用法及び用量に関連する注意
〈切除不能な進行・再発の非小細胞肺癌〉
他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍は、
「17.臨床成績」の項の内容を熟知し、臨床試験において検討された
患者の PD-L1 発現率を考慮した上で選択すること。
7. 用法及び用量に関連する注意
〈切除不能な進行・再発の非小細胞肺癌〉
他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍は、
「17.臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等
を参考にした上で、臨床試験において検討された患者の PD-L1 発
現率を考慮した上で選択すること。
〈非小細胞肺癌における術前補助療法〉
併用する他の抗悪性腫瘍剤は、「17.臨床成績」の項の内容を熟知し
選択すること。
〈非小細胞肺癌における術前補助療法〉
併用する他の抗悪性腫瘍剤は、「17.臨床成績」の項の内容を熟知
し、国内外の最新のガイドライン等を参考にした上で、選択する
こと。
〈治癒切除不能な進行・再発の胃癌〉
〈治癒切除不能な進行・再発の胃癌〉
21