よむ、つかう、まなぶ。
資料2-1 医薬品等の使用上の注意の改訂について [289KB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
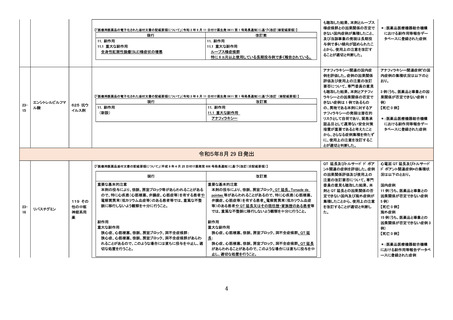
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領 )】
現行
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
改訂案
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
重症筋無力症又はその既往歴のある患者
重症筋無力症(眼筋型、全身型)が悪化又は再発することが
ある。
11. 副作用
11.1 重大な副作用
(新設)
11. 副作用
11.1 重大な副作用
重症筋無力症
重症筋無力症(眼筋型、全身型)が発症又は悪化することが
ある。
2
る副作用報告数がデータベー
ス全体から予測される値より
統計学的に有意に高かった
(報告オッズ比[95%信頼区
間] = 2.66[2.28-3.10])との報
告注 4,注 5 があること。また、機構
で実施した VigiBase の 2023
年 5 月 23 日時点のデータセ
ットを用いた不均衡分析にお
いても、同様の結果(重症筋
無力症:IC025 注 6 = 0.9、眼筋無
力症:IC025 = 1.7)が示されたこ
と注 4。 (別添参照:
https://www.pmda.go.jp/files/
000263347.pdf)
・ 国内外のガイドライン注 7 で、重
症筋無力症において注意を要
する薬剤としてスタチンが記載
されていること。
注 1:Medicine. 2015; 94: e416
注 2:Eur J Neurol. 2008; 15:
e92-3、J Med Assoc Thai.
2011; 94: 256-8
注 3:VigiBase は、医薬品による
副作用が疑われる症例が収
められた WHO(世界保健機
関)のグローバルデータベース
であり、UMC(ウプサラモニタリ
ングセンター) により開発・維
持されている。情報源は様々
であり、疑われた副作用が医
薬品と関連する可能性はすべ
ての症例で同一ということでは
ない。
注 4:WHO 又は UMC の見解で
はない。
注 5:Muscle & Nerve. 2019; 60:
382-6
注 6:Information Component
(IC)の 95%信頼区間下限値
注 7:重症筋無力症/ランバー
ト・イートン筋無力症候群の診
療ガイドライン 2022(日本神経
学会監修)、International
Consensus Guidance for
Management of Myasthenia
Gravis 2020(Neurology. 2021;
96: 114-122)
⑥1 例(うち、医薬品と事象との
因果関係が否定できない症例
0 例)
【死亡 0 例】
②~⑤、⑦~⑩ 0 例
<眼筋無力症>
①~⑩ 0 例
注 8:医薬品医療機器総合機構
における副作用等報告デー
タベースに登録された症例
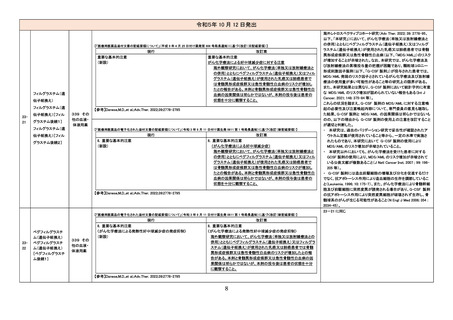
現行
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
改訂案
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
重症筋無力症又はその既往歴のある患者
重症筋無力症(眼筋型、全身型)が悪化又は再発することが
ある。
11. 副作用
11.1 重大な副作用
(新設)
11. 副作用
11.1 重大な副作用
重症筋無力症
重症筋無力症(眼筋型、全身型)が発症又は悪化することが
ある。
2
る副作用報告数がデータベー
ス全体から予測される値より
統計学的に有意に高かった
(報告オッズ比[95%信頼区
間] = 2.66[2.28-3.10])との報
告注 4,注 5 があること。また、機構
で実施した VigiBase の 2023
年 5 月 23 日時点のデータセ
ットを用いた不均衡分析にお
いても、同様の結果(重症筋
無力症:IC025 注 6 = 0.9、眼筋無
力症:IC025 = 1.7)が示されたこ
と注 4。 (別添参照:
https://www.pmda.go.jp/files/
000263347.pdf)
・ 国内外のガイドライン注 7 で、重
症筋無力症において注意を要
する薬剤としてスタチンが記載
されていること。
注 1:Medicine. 2015; 94: e416
注 2:Eur J Neurol. 2008; 15:
e92-3、J Med Assoc Thai.
2011; 94: 256-8
注 3:VigiBase は、医薬品による
副作用が疑われる症例が収
められた WHO(世界保健機
関)のグローバルデータベース
であり、UMC(ウプサラモニタリ
ングセンター) により開発・維
持されている。情報源は様々
であり、疑われた副作用が医
薬品と関連する可能性はすべ
ての症例で同一ということでは
ない。
注 4:WHO 又は UMC の見解で
はない。
注 5:Muscle & Nerve. 2019; 60:
382-6
注 6:Information Component
(IC)の 95%信頼区間下限値
注 7:重症筋無力症/ランバー
ト・イートン筋無力症候群の診
療ガイドライン 2022(日本神経
学会監修)、International
Consensus Guidance for
Management of Myasthenia
Gravis 2020(Neurology. 2021;
96: 114-122)
⑥1 例(うち、医薬品と事象との
因果関係が否定できない症例
0 例)
【死亡 0 例】
②~⑤、⑦~⑩ 0 例
<眼筋無力症>
①~⑩ 0 例
注 8:医薬品医療機器総合機構
における副作用等報告デー
タベースに登録された症例