よむ、つかう、まなぶ。
資料2-1 医薬品等の使用上の注意の改訂について [289KB] (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
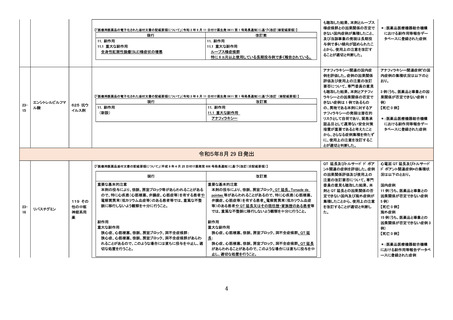
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
2319
ペフィシチニブ臭化
水素酸塩
399 他に
分類され
ない代謝
性医薬品
現行
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
改訂案
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
静脈血栓塞栓症のリスクを有する患者
11. 副作用
11.1 重大な副作用
(新設)
11. 副作用
11.1 重大な副作用
静脈血栓塞栓症
肺塞栓症及び深部静脈血栓症があらわれることがある。
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂(旧記載要領)】
現行
改訂案
重要な基本的注意
重要な基本的注意
本剤によるショック、アナフィラキシーの発生を確実に予知できる方
本剤によるショック、アナフィラキシー、アレルギー反応に伴う急性
法がないので、次の措置をとること。
冠症候群の発生を確実に予知できる方法がないので、次の措置を
とること。
副作用
重大な副作用
(新設)
2320
セファゾリンナトリウ
ム
セファゾリンナトリウ
ム水和物
副作用
重大な副作用
アレルギー反応に伴う急性冠症候群:
アレルギー反応に伴う急性冠症候群があらわれることがあるの
で、観察を十分に行い、異常が認められた場合には投与を中止
し、適切な処置を行うこと。
613 主と
してグラム
陽性・陰性
菌に作用
するもの
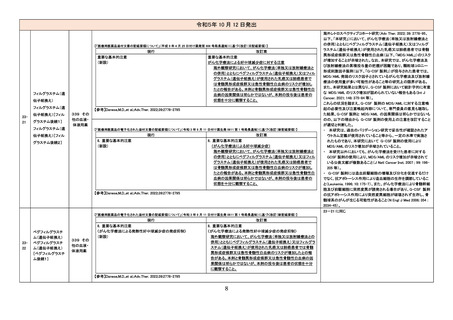
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
改訂案
8. 重要な基本的注意
8. 重要な基本的注意
本剤によるショック、アナフィラキシーの発生を確実に予知できる方
本剤によるショック、アナフィラキシー、アレルギー反応に伴う急性
法がないので、次の措置をとること。
冠症候群の発生を確実に予知できる方法がないので、次の措置を
とること。
11. 副作用
11.1 重大な副作用
(新設)
11. 副作用
11.1 重大な副作用
アレルギー反応に伴う急性冠症候群
7
静脈血栓塞栓症関連の国内症
例を評価した。症例の因果関係
評価及び使用上の注意の改訂
要否について、専門委員の意見
も聴取した結果、本剤と静脈血
栓塞栓症との因果関係の否定で
きない国内症例が確認されたこ
と、類薬の添付文書において既
に当該事象に関する注意喚起が
なされていること等を踏まえ、使
用上の注意を改訂することが適
切と判断した。
アレルギー反応に伴う急性冠症
候群の国内症例を評価した。症
例の因果関係評価及び使用上
の注意の改訂要否について、専
門委員の意見も聴取した結果、
本剤とアレルギー反応に伴う急
性冠症候群との因果関係の否定
できない国内症例が集積したこ
とから、使用上の注意を改訂す
ることが適切と判断した。
静脈血栓塞栓症関連症例*の国
内症例の集積状況は以下のと
おり。
5 例(うち、医薬品と事象との因
果関係が否定できない症例 1
例)
【死亡 0 例】
*:医薬品医療機器総合機構
における副作用等報告デー
タベースに登録された症例
アレルギー反応に伴う急性冠症
候群関連症例*の国内症例の集
積状況は以下のとおり。
7 例(うち、医薬品と事象との因
果関係が否定できない症例 7
例)
【死亡 0 例】
*:医薬品医療機器総合機構
における副作用等報告デー
タベースに登録された症例
2319
ペフィシチニブ臭化
水素酸塩
399 他に
分類され
ない代謝
性医薬品
現行
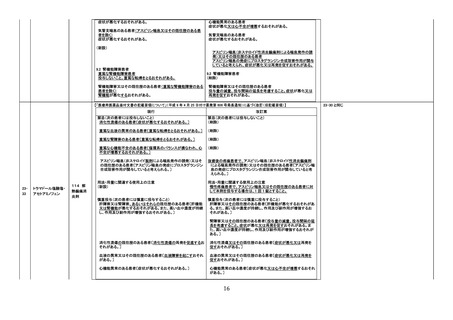
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
改訂案
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
静脈血栓塞栓症のリスクを有する患者
11. 副作用
11.1 重大な副作用
(新設)
11. 副作用
11.1 重大な副作用
静脈血栓塞栓症
肺塞栓症及び深部静脈血栓症があらわれることがある。
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂(旧記載要領)】
現行
改訂案
重要な基本的注意
重要な基本的注意
本剤によるショック、アナフィラキシーの発生を確実に予知できる方
本剤によるショック、アナフィラキシー、アレルギー反応に伴う急性
法がないので、次の措置をとること。
冠症候群の発生を確実に予知できる方法がないので、次の措置を
とること。
副作用
重大な副作用
(新設)
2320
セファゾリンナトリウ
ム
セファゾリンナトリウ
ム水和物
副作用
重大な副作用
アレルギー反応に伴う急性冠症候群:
アレルギー反応に伴う急性冠症候群があらわれることがあるの
で、観察を十分に行い、異常が認められた場合には投与を中止
し、適切な処置を行うこと。
613 主と
してグラム
陽性・陰性
菌に作用
するもの
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
改訂案
8. 重要な基本的注意
8. 重要な基本的注意
本剤によるショック、アナフィラキシーの発生を確実に予知できる方
本剤によるショック、アナフィラキシー、アレルギー反応に伴う急性
法がないので、次の措置をとること。
冠症候群の発生を確実に予知できる方法がないので、次の措置を
とること。
11. 副作用
11.1 重大な副作用
(新設)
11. 副作用
11.1 重大な副作用
アレルギー反応に伴う急性冠症候群
7
静脈血栓塞栓症関連の国内症
例を評価した。症例の因果関係
評価及び使用上の注意の改訂
要否について、専門委員の意見
も聴取した結果、本剤と静脈血
栓塞栓症との因果関係の否定で
きない国内症例が確認されたこ
と、類薬の添付文書において既
に当該事象に関する注意喚起が
なされていること等を踏まえ、使
用上の注意を改訂することが適
切と判断した。
アレルギー反応に伴う急性冠症
候群の国内症例を評価した。症
例の因果関係評価及び使用上
の注意の改訂要否について、専
門委員の意見も聴取した結果、
本剤とアレルギー反応に伴う急
性冠症候群との因果関係の否定
できない国内症例が集積したこ
とから、使用上の注意を改訂す
ることが適切と判断した。
静脈血栓塞栓症関連症例*の国
内症例の集積状況は以下のと
おり。
5 例(うち、医薬品と事象との因
果関係が否定できない症例 1
例)
【死亡 0 例】
*:医薬品医療機器総合機構
における副作用等報告デー
タベースに登録された症例
アレルギー反応に伴う急性冠症
候群関連症例*の国内症例の集
積状況は以下のとおり。
7 例(うち、医薬品と事象との因
果関係が否定できない症例 7
例)
【死亡 0 例】
*:医薬品医療機器総合機構
における副作用等報告デー
タベースに登録された症例