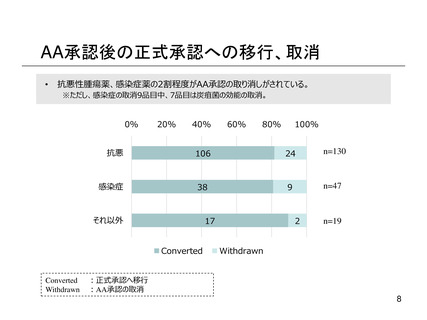
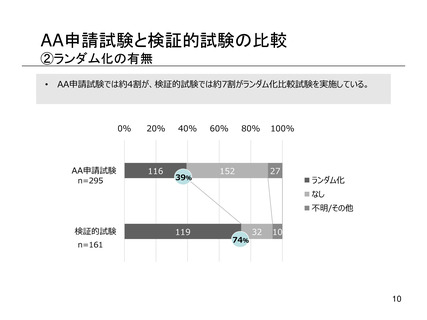
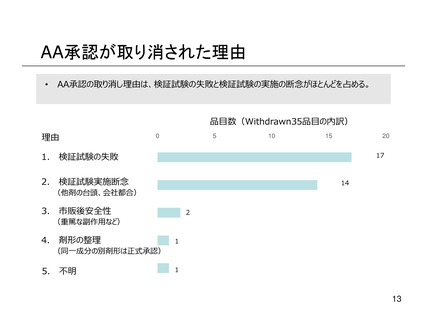
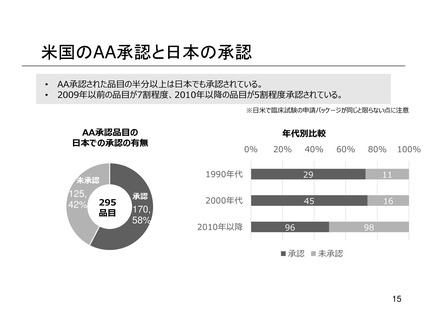
よむ、つかう、まなぶ。
【資料3】研究班からの報告資料 (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36390.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第6回 12/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
米国の迅速承認制度に対する製薬企業の評価 (2)
3. 迅速承認の条件とされた検証的試験について、当該薬剤が医療保険で使用可
能であるため被験者の確保が難しくなるなど、実施にあたっての課題はあるか。
➢ 被験者確保の面での課題は多い。
➢ このため、迅速承認の適応よりも広い適応(例:抗がん剤について、より早期の
治療ライン)で検証的試験を行う、迅速承認後も同じ試験を継続してより長期間
の臨床エンドポイントを評価するなどの工夫をしている。
4. 迅速承認が取り消された場合、企業から医療従事者や患者に対して何らかの対
応が求められるか。
➢ 製品自体の承認取消/一部効能の取消、有効性/安全性上の理由による取消
など様々なパターンがある。
➢ 規制上、企業にそのような対応は求められていないが、当該製品によるベネフィ
ットを享受している患者に対しては、何らかの対応がなされることが多い。
•
迅速承認が取り消された抗がん剤について、一定の条件を満たす患者にはコンパッショネートユー
スプログラムにより継続使用の機会を確保するなど
22
3. 迅速承認の条件とされた検証的試験について、当該薬剤が医療保険で使用可
能であるため被験者の確保が難しくなるなど、実施にあたっての課題はあるか。
➢ 被験者確保の面での課題は多い。
➢ このため、迅速承認の適応よりも広い適応(例:抗がん剤について、より早期の
治療ライン)で検証的試験を行う、迅速承認後も同じ試験を継続してより長期間
の臨床エンドポイントを評価するなどの工夫をしている。
4. 迅速承認が取り消された場合、企業から医療従事者や患者に対して何らかの対
応が求められるか。
➢ 製品自体の承認取消/一部効能の取消、有効性/安全性上の理由による取消
など様々なパターンがある。
➢ 規制上、企業にそのような対応は求められていないが、当該製品によるベネフィ
ットを享受している患者に対しては、何らかの対応がなされることが多い。
•
迅速承認が取り消された抗がん剤について、一定の条件を満たす患者にはコンパッショネートユー
スプログラムにより継続使用の機会を確保するなど
22