よむ、つかう、まなぶ。
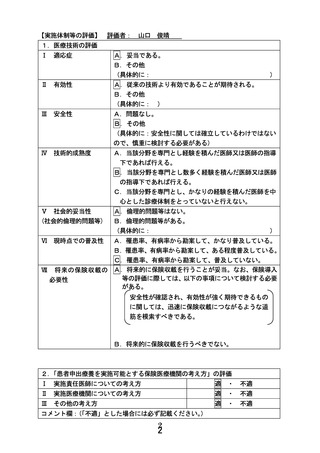
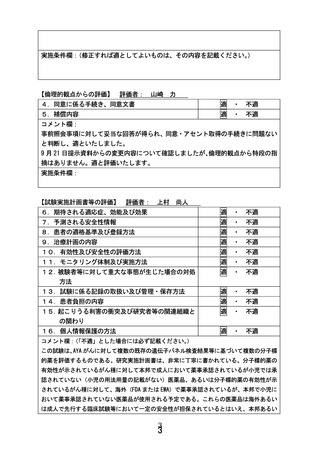
別紙1○患者申出療養に係る新規技術の科学的評価等について (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00029.html |
| 出典情報 | 患者申出療養評価会議(第47回 12/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
患者申出療養評価会議事前評価構成員からの確認事項に対する回答
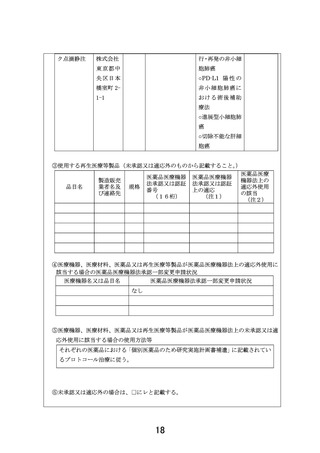
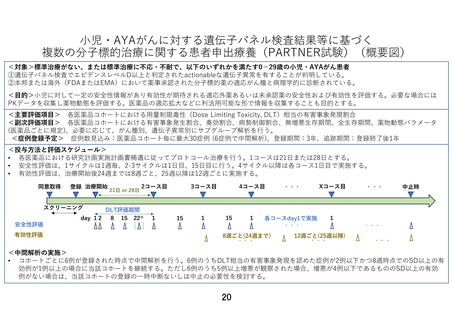
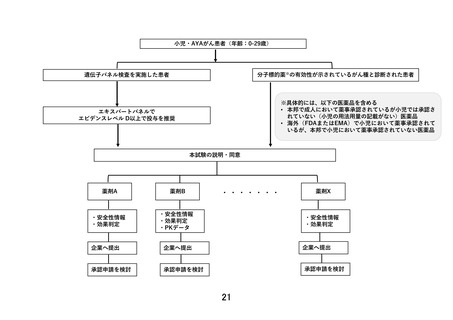
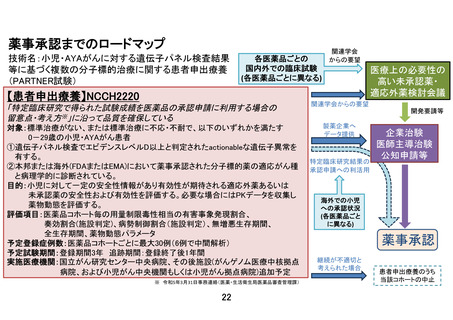
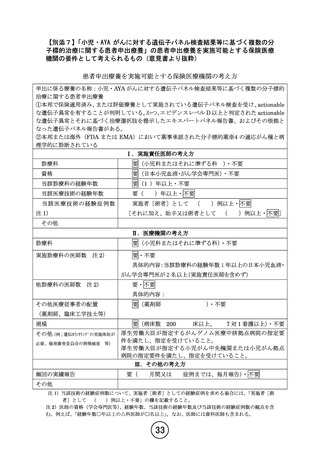
患者申出療養技術名:小児・AYA がんに対する遺伝子パネル検査結果等に基づく
複数の分子標的治療に関する患者申出療養
令和 5 年 12 月 4 日
所属:国立がん研究センター中央病院 小児腫瘍科
氏名:小川 千登世
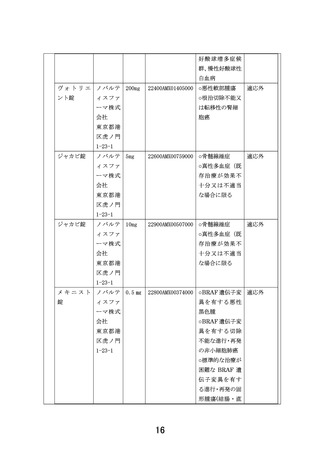
1.本研究について、現時点では医薬品提供企業がノバルティスファーマ社と中外製薬の2社になっ
ているが、研究実施計画書の「2.2.4. 本研究で使用可能な医薬品」に「本研究には、企業との交渉に
より、無償提供される医薬品を複数含む。」と記載されています。
・ 当該研究の対象とする医薬品はどのような基準で企業と交渉する候補としたのか
・ 現時点での企業との交渉状況はどうなっているのか
・ 何故現時点で医薬品提供企業がノバルティスファーマと中外製薬の2社となっているのか
についてお答えください。
【回答】
本研究が対象とする医薬品の選択については、2022 年に第 64 回小児血液・がん学会学術集会にて
当院が発表致しました「C-CAT リアルワールドデータの解析:小児固形腫瘍における開発優先度の高
い分子標的薬の同定 1)」の結果などを参考に検討しております。小児・AYA 世代の再発・難治性固形腫
瘍に対して必要とされている分子標的薬は多岐に渡るため、多くの企業が対象医薬品を製造販売して
おりますが、複数の患者がすでに治療を待っている状況でしたので、速やかな研究開始が期待されてい
るところです。そこで、本研究の対象として検討している医薬品の候補のうち、まずは当院で実施中の成
人での複数の医薬品を対象とした患者申出療養 NCCH1901 試験(jRCTs031190104)に参加頂いてい
る企業を中心に、患者申出療養への薬剤提供の経験があるという観点で、相談を始めました。現在まで
にノバルティス社以外にもこれまで 8 社と交渉し、うち 1 社は患者申出療養への薬剤提供ではなく、企
業治験の実施について検討いただけることとなり、本研究の対象外となりました。企業によって患者申出
療養に医薬品提供の可否を決定するプロセスに違いがございましたため、最初にノバルティスファーマ
社と医薬品提供についての合意が得られました。よって、第 32 回患者申出療養評価会議に申請した際
にはその時点で認定臨床研究委員会の承認を得られておりましたノバルティスファーマ社の 4 医薬品を
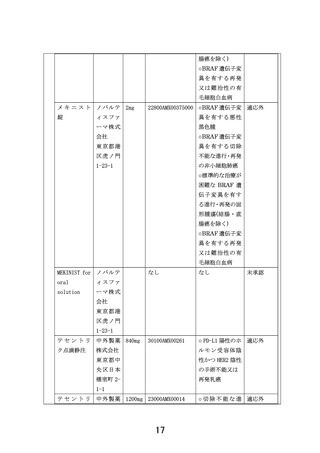
含めました。その後、4 社から医薬品提供が可能である旨、お返事を頂いております。そのうち中外製薬
株式会社のアテゾリズマブについては企業との調整が進んだためプロトコール改訂を行い、11 月 30 日
の認定臨床研究審査委員会にて承認されました。他 3 社の本研究への参画についても今後プロトコー
ル改訂をし、対象医薬品として追加する予定です。患者申出療養への医薬品提供の可否については現
在 1 社に審議、検討頂いております。
今後も患者さんからのニーズに応じて、本研究に含める医薬品の拡大を検討して参ります。
10
患者申出療養技術名:小児・AYA がんに対する遺伝子パネル検査結果等に基づく
複数の分子標的治療に関する患者申出療養
令和 5 年 12 月 4 日
所属:国立がん研究センター中央病院 小児腫瘍科
氏名:小川 千登世
1.本研究について、現時点では医薬品提供企業がノバルティスファーマ社と中外製薬の2社になっ
ているが、研究実施計画書の「2.2.4. 本研究で使用可能な医薬品」に「本研究には、企業との交渉に
より、無償提供される医薬品を複数含む。」と記載されています。
・ 当該研究の対象とする医薬品はどのような基準で企業と交渉する候補としたのか
・ 現時点での企業との交渉状況はどうなっているのか
・ 何故現時点で医薬品提供企業がノバルティスファーマと中外製薬の2社となっているのか
についてお答えください。
【回答】
本研究が対象とする医薬品の選択については、2022 年に第 64 回小児血液・がん学会学術集会にて
当院が発表致しました「C-CAT リアルワールドデータの解析:小児固形腫瘍における開発優先度の高
い分子標的薬の同定 1)」の結果などを参考に検討しております。小児・AYA 世代の再発・難治性固形腫
瘍に対して必要とされている分子標的薬は多岐に渡るため、多くの企業が対象医薬品を製造販売して
おりますが、複数の患者がすでに治療を待っている状況でしたので、速やかな研究開始が期待されてい
るところです。そこで、本研究の対象として検討している医薬品の候補のうち、まずは当院で実施中の成
人での複数の医薬品を対象とした患者申出療養 NCCH1901 試験(jRCTs031190104)に参加頂いてい
る企業を中心に、患者申出療養への薬剤提供の経験があるという観点で、相談を始めました。現在まで
にノバルティス社以外にもこれまで 8 社と交渉し、うち 1 社は患者申出療養への薬剤提供ではなく、企
業治験の実施について検討いただけることとなり、本研究の対象外となりました。企業によって患者申出
療養に医薬品提供の可否を決定するプロセスに違いがございましたため、最初にノバルティスファーマ
社と医薬品提供についての合意が得られました。よって、第 32 回患者申出療養評価会議に申請した際
にはその時点で認定臨床研究委員会の承認を得られておりましたノバルティスファーマ社の 4 医薬品を
含めました。その後、4 社から医薬品提供が可能である旨、お返事を頂いております。そのうち中外製薬
株式会社のアテゾリズマブについては企業との調整が進んだためプロトコール改訂を行い、11 月 30 日
の認定臨床研究審査委員会にて承認されました。他 3 社の本研究への参画についても今後プロトコー
ル改訂をし、対象医薬品として追加する予定です。患者申出療養への医薬品提供の可否については現
在 1 社に審議、検討頂いております。
今後も患者さんからのニーズに応じて、本研究に含める医薬品の拡大を検討して参ります。
10