よむ、つかう、まなぶ。
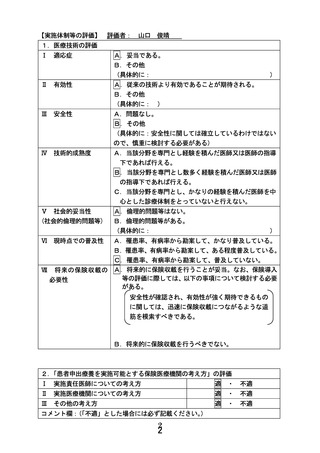
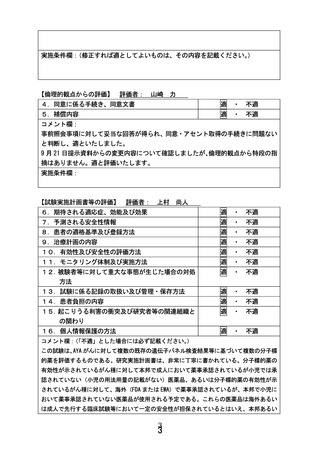
別紙1○患者申出療養に係る新規技術の科学的評価等について (29 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00029.html |
| 出典情報 | 患者申出療養評価会議(第47回 12/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
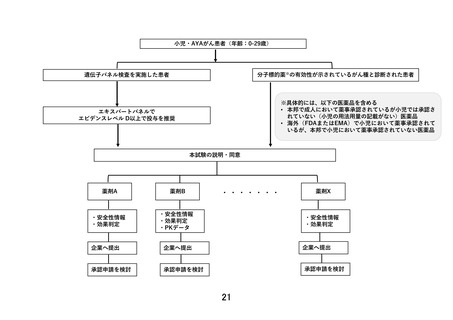
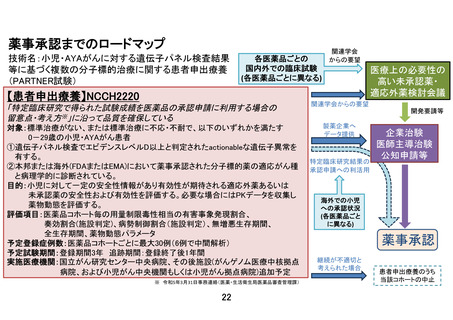
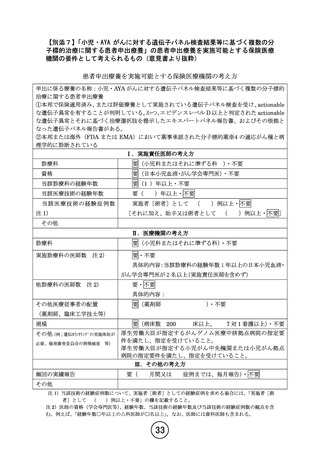
【別添4】「小児・AYA がんに対する遺伝子パネル検査結果等に基づく複数の分
子標的治療に関する患者申出療養」の有効性及び安全性の評価(意見書より抜粋)
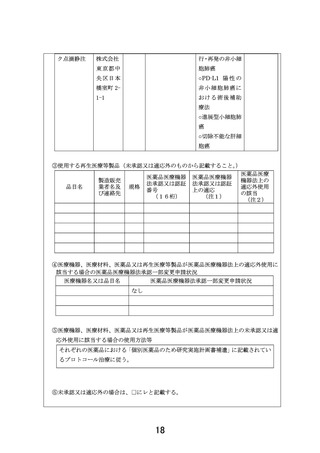
7-1.有効性及び安全性の評価
Primary endpoint:
各医薬品コホートにおける用量制限毒性(Dose Limiting Toxicity, DLT)相当の有害事象
発現割合
Secondary endpoints:
各医薬品コホートにおける
1)安全性のエンドポイント:有害事象発生割合
2)有効性のエンドポイント:奏効割合(施設判定)
、病勢制御割合(施設判定)
、無増悪生存
期間、全生存期間
3)薬物動態パラメータ (医薬品コホートごとに研究実施計画書補遺(付録 1)で規定する)
必要に応じて、がん種別、遺伝子異常別にサブグループ解析を行う。
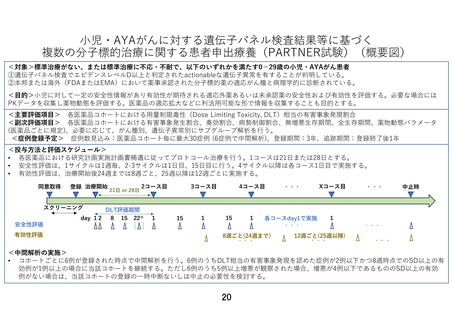
有効性の評価:
腫瘍評価のための画像検査(CT または MRI)は、プロトコール治療開始日を起算日として、
プロトコール治療開始後 24 週までは 8 週ごと、25 週以降は 12 週ごとに実施する。本研究で
は中間解析として治療開始後 8 週時点の有効性評価を用いるため、休薬・中断中であっても
必ず 8 週で画像検査を実施する。登録前評価において使用したモダリティおよび撮影条件が
同じものを使用する。脳腫瘍の場合、頭部は造影 MRI を必須とする。また、骨髄病変を有す
る患者では、画像検査と同じタイミングで、骨髄検査を実施する。
腫瘍縮小効果判定は「固形がんの治療効果判定のための新ガイドライン(RECIST ガイドライ
ン)改訂版 version 1.1―日本語訳 JCOG 版―:Revised RECIST guideline(version 1.1)
」
(13)に従った以下の手順により行う。脳腫瘍に関しては、RECISTv1.1 でのベースライン評価
に加えて RANO 規準による評価も行う。
総合効果で初めて CR または PR が認められた場合、その 4 週以降に確定(confirmation)の
ための画像検査を追加で実施する。
本研究で収集する画像データは原則として、規定の検査として実施されたデータ、PD 判定の
根拠となったデータ、および CR または PR 確定時のデータとする。
安全性の評価:
安全性評価は、投与開始後 3 サイクルまでは 2 週間毎、4 サイクル以降は 1 か月毎で実施す
る。1 サイクルでは、Primary endpoint である DLT 相当の有害事象を評価し、6 例登録され
た時点で中間解析を行う。中間解析にて、6 例中 3 例以上に DLT 相当の有害事象が認められ
た場合、有害事象の内容やリスクベネフィット、減量によって改善すると考えられる有害事
象であるか否か、本邦で小児を対象とした治験が終了し小児に対する安全性が十分に評価さ
れているか否か、などを精査した上で当該医薬品コホートの登録中止の要否を検討し、試験
継続の是非について効果・安全性評価委員会に諮問する。DLT 相当の有害事象が、6 例中 2 例
29
子標的治療に関する患者申出療養」の有効性及び安全性の評価(意見書より抜粋)
7-1.有効性及び安全性の評価
Primary endpoint:
各医薬品コホートにおける用量制限毒性(Dose Limiting Toxicity, DLT)相当の有害事象
発現割合
Secondary endpoints:
各医薬品コホートにおける
1)安全性のエンドポイント:有害事象発生割合
2)有効性のエンドポイント:奏効割合(施設判定)
、病勢制御割合(施設判定)
、無増悪生存
期間、全生存期間
3)薬物動態パラメータ (医薬品コホートごとに研究実施計画書補遺(付録 1)で規定する)
必要に応じて、がん種別、遺伝子異常別にサブグループ解析を行う。
有効性の評価:
腫瘍評価のための画像検査(CT または MRI)は、プロトコール治療開始日を起算日として、
プロトコール治療開始後 24 週までは 8 週ごと、25 週以降は 12 週ごとに実施する。本研究で
は中間解析として治療開始後 8 週時点の有効性評価を用いるため、休薬・中断中であっても
必ず 8 週で画像検査を実施する。登録前評価において使用したモダリティおよび撮影条件が
同じものを使用する。脳腫瘍の場合、頭部は造影 MRI を必須とする。また、骨髄病変を有す
る患者では、画像検査と同じタイミングで、骨髄検査を実施する。
腫瘍縮小効果判定は「固形がんの治療効果判定のための新ガイドライン(RECIST ガイドライ
ン)改訂版 version 1.1―日本語訳 JCOG 版―:Revised RECIST guideline(version 1.1)
」
(13)に従った以下の手順により行う。脳腫瘍に関しては、RECISTv1.1 でのベースライン評価
に加えて RANO 規準による評価も行う。
総合効果で初めて CR または PR が認められた場合、その 4 週以降に確定(confirmation)の
ための画像検査を追加で実施する。
本研究で収集する画像データは原則として、規定の検査として実施されたデータ、PD 判定の
根拠となったデータ、および CR または PR 確定時のデータとする。
安全性の評価:
安全性評価は、投与開始後 3 サイクルまでは 2 週間毎、4 サイクル以降は 1 か月毎で実施す
る。1 サイクルでは、Primary endpoint である DLT 相当の有害事象を評価し、6 例登録され
た時点で中間解析を行う。中間解析にて、6 例中 3 例以上に DLT 相当の有害事象が認められ
た場合、有害事象の内容やリスクベネフィット、減量によって改善すると考えられる有害事
象であるか否か、本邦で小児を対象とした治験が終了し小児に対する安全性が十分に評価さ
れているか否か、などを精査した上で当該医薬品コホートの登録中止の要否を検討し、試験
継続の是非について効果・安全性評価委員会に諮問する。DLT 相当の有害事象が、6 例中 2 例
29