よむ、つかう、まなぶ。
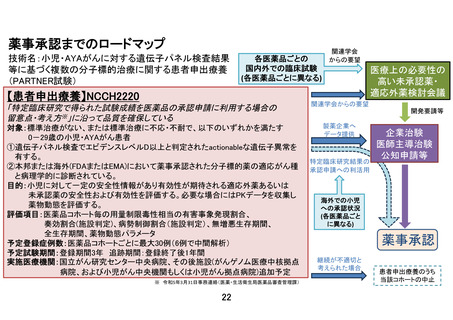
別紙1○患者申出療養に係る新規技術の科学的評価等について (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00029.html |
| 出典情報 | 患者申出療養評価会議(第47回 12/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
「②本邦または海外(FDA または EMA)において薬事承認された分子標的薬の適応がん種と病理学的
に診断されている。」のうち、「分子標的薬の有効性が示されているがん種に対して、海外(FDA または
EMA)で小児において薬事承認されているが、本邦で小児において薬事承認されていない医薬品」を満
たして参加を希望する場合:
→NCCH1901 試験の対象医薬品となっていないため、本研究に参加頂く。本研究における対象年齢は
該当薬剤の海外での薬事承認範囲を踏まえて、それぞれ規定いたします。
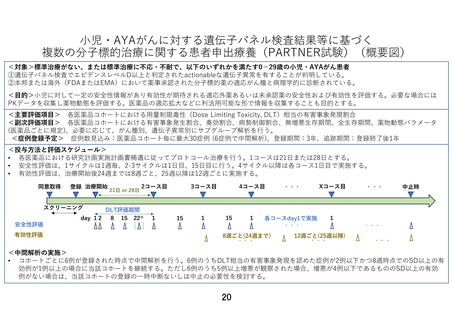
4.第 32 回患者申出療養評価会議(令和5年9月 21 日開催)において提示された研究実施計画から
変更が行われた理由を説明下さい。
【回答】
第 32 回患者申出療養評価会議に提出致しました研究実施計画との主な変更点について以下ご説明い
たします。
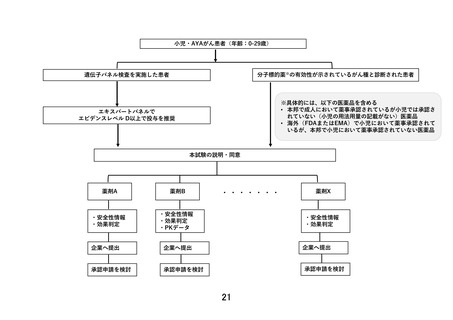
① 本研究における対象医薬品追加について
遺伝子パネル検査の結果等から、奏効が期待され小児がん患者から使用希望が強い医薬品を本
研究の対象に含めるよう製薬企業と交渉してきました。企業ごとに交渉に係る時間は異なるもの
の、特に小児がん患者から要望の強い医薬品においては、早急に組み入れられるよう対応してきま
した。アテゾリズマブは、米国において一部のがん種において 2 歳以上の小児患者に対して使用可
能ですが、日本においては小児患者に対する開発は行われておりません。しかし、米国で承認され
ているがん種や、本邦で成人に対して承認されているがん種に対して、小児がん患者から使用要望
があり、本研究を通じて治療機会の提供及びその後の開発を行うことが求められていました。この
度、中外製薬株式会社から研究参加の合意が得られたためプロトコール改訂を行い、11 月 30 日の
認定臨床研究審査委員会にて承認されました。そのため、今回の申請におきましてはアテゾリズマ
ブの実施計画書補遺、アテゾリズマブの説明文書、アテゾリズマブのアセント文書(3 種類)を追加し
ました。
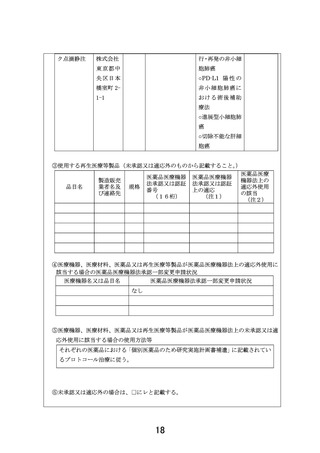
② 研究実施計画書における遺伝子パネル検査の定義の変更について(3.2. 遺伝子パネルの定義)
本研究では、本邦で薬事承認済み、あるいは評価療養として実施されている(登録終了したものを
含む)以下の遺伝子パネル検査を対象としております。今回 GenMineTOP®がんゲノムプロファイリン
グシステムが 2023 年 8 月 1 日より保険適用となったため、GenMineTOP®がんゲノムプロファイリン
グシステムを対象遺伝子パネル検査として追加しました。対象とする遺伝子パネル検査を適宜増や
すことで、より多くの小児がん患者に必要としている医薬品を幅広く迅速に届けたいと思っていま
す。
③ 研究実施計画書における治療中止規準の変更について(6.2.2 プロトコール治療中止規準)
本研究では、Grade 4 の有害事象が発生した場合は、医薬品との因果関係を問わず、全例プロトコ
ール治療は中止としておりました。しかし、医薬品との因果関係がなく、その事象が軽快・回復の転
8
に診断されている。」のうち、「分子標的薬の有効性が示されているがん種に対して、海外(FDA または
EMA)で小児において薬事承認されているが、本邦で小児において薬事承認されていない医薬品」を満
たして参加を希望する場合:
→NCCH1901 試験の対象医薬品となっていないため、本研究に参加頂く。本研究における対象年齢は
該当薬剤の海外での薬事承認範囲を踏まえて、それぞれ規定いたします。
4.第 32 回患者申出療養評価会議(令和5年9月 21 日開催)において提示された研究実施計画から
変更が行われた理由を説明下さい。
【回答】
第 32 回患者申出療養評価会議に提出致しました研究実施計画との主な変更点について以下ご説明い
たします。
① 本研究における対象医薬品追加について
遺伝子パネル検査の結果等から、奏効が期待され小児がん患者から使用希望が強い医薬品を本
研究の対象に含めるよう製薬企業と交渉してきました。企業ごとに交渉に係る時間は異なるもの
の、特に小児がん患者から要望の強い医薬品においては、早急に組み入れられるよう対応してきま
した。アテゾリズマブは、米国において一部のがん種において 2 歳以上の小児患者に対して使用可
能ですが、日本においては小児患者に対する開発は行われておりません。しかし、米国で承認され
ているがん種や、本邦で成人に対して承認されているがん種に対して、小児がん患者から使用要望
があり、本研究を通じて治療機会の提供及びその後の開発を行うことが求められていました。この
度、中外製薬株式会社から研究参加の合意が得られたためプロトコール改訂を行い、11 月 30 日の
認定臨床研究審査委員会にて承認されました。そのため、今回の申請におきましてはアテゾリズマ
ブの実施計画書補遺、アテゾリズマブの説明文書、アテゾリズマブのアセント文書(3 種類)を追加し
ました。
② 研究実施計画書における遺伝子パネル検査の定義の変更について(3.2. 遺伝子パネルの定義)
本研究では、本邦で薬事承認済み、あるいは評価療養として実施されている(登録終了したものを
含む)以下の遺伝子パネル検査を対象としております。今回 GenMineTOP®がんゲノムプロファイリン
グシステムが 2023 年 8 月 1 日より保険適用となったため、GenMineTOP®がんゲノムプロファイリン
グシステムを対象遺伝子パネル検査として追加しました。対象とする遺伝子パネル検査を適宜増や
すことで、より多くの小児がん患者に必要としている医薬品を幅広く迅速に届けたいと思っていま
す。
③ 研究実施計画書における治療中止規準の変更について(6.2.2 プロトコール治療中止規準)
本研究では、Grade 4 の有害事象が発生した場合は、医薬品との因果関係を問わず、全例プロトコ
ール治療は中止としておりました。しかし、医薬品との因果関係がなく、その事象が軽快・回復の転
8