よむ、つかう、まなぶ。
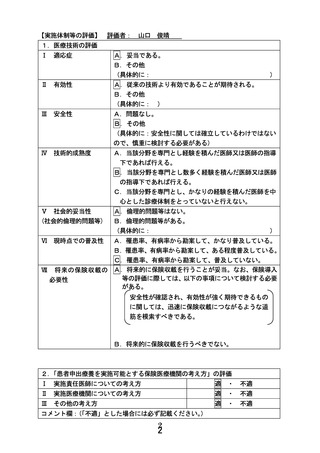
別紙1○患者申出療養に係る新規技術の科学的評価等について (20 ページ)
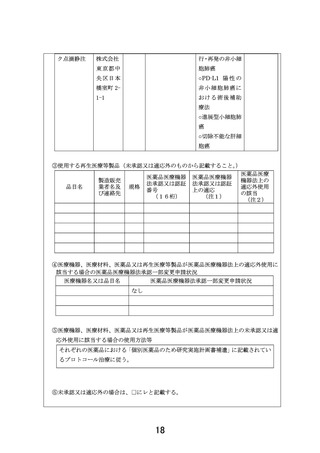
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00029.html |
| 出典情報 | 患者申出療養評価会議(第47回 12/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
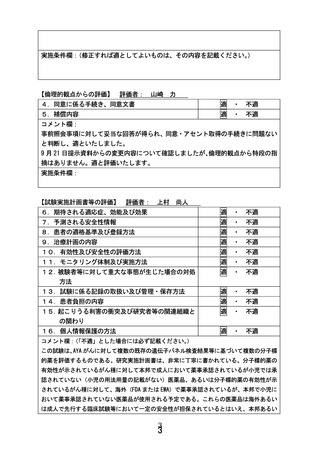
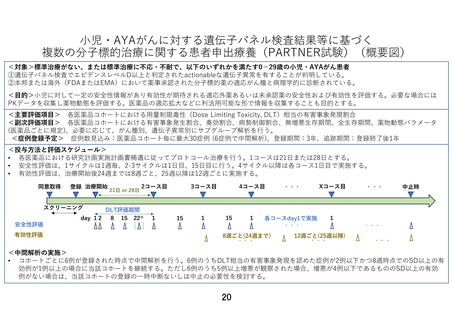
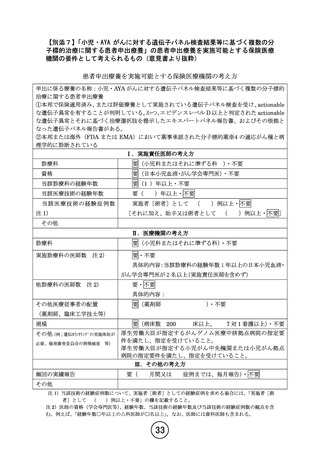
小児・AYAがんに対する遺伝子パネル検査結果等に基づく
複数の分子標的治療に関する患者申出療養(PARTNER試験)(概要図)
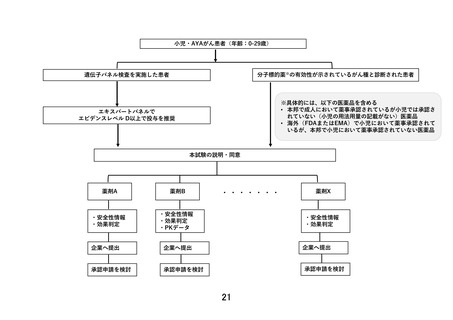
<対象>標準治療がない、または標準治療に不応・不耐で、以下のいずれかを満たす0-29歳の小児・AYAがん患者
①遺伝子パネル検査でエビデンスレベルD以上と判定されたactionableな遺伝子異常を有することが判明している。
②本邦または海外(FDAまたはEMA)において薬事承認された分子標的薬の適応がん種と病理学的に診断されている。
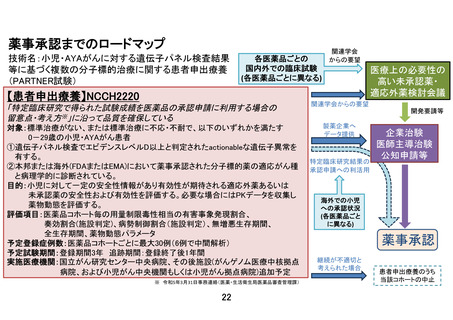
<目的>小児に対して一定の安全性情報があり有効性が期待される適応外薬あるいは未承認薬の安全性および有効性を評価する。必要な場合には
PKデータを収集し薬物動態を評価する。医薬品の適応拡大などに利活用可能な形で情報を収集することも目的とする。
<主要評価項目> 各医薬品コホートにおける用量制限毒性(Dose Limiting Toxicity, DLT)相当の有害事象発現割合
<副次評価項目> 各医薬品コホートにおける有害事象発生割合、奏効割合、病勢制御割合、無増悪生存期間、全生存期間、薬物動態パラメータ
(医薬品ごとに規定)、必要に応じて、がん種別、遺伝子異常別にサブグループ解析を行う。
<症例登録予定> 症例数見込み:医薬品コホート毎に最大30症例 (6症例で中間解析)、登録期間:3年、追跡期間:登録終了後1年
<投与方法と評価スケジュール>
• 各医薬品における研究計画実施計画書補遺に従ってプロトコール治療を行う。1コースは21日または28日とする。
• 安全性評価は、1サイクルは1週毎、2-3サイクルは1日目、15日目に行う。4サイクル以降は各コース1日目で実施する。
• 有効性評価は、治療開始後24週までは8週ごと、25週以降は12週ごとに実施する。
同意取得
登録 治療開始
21日 or 28日
2コース目
3コース目
・・・
Xコース目
各コースday1で実施
・・・
1
4コース目
・・・
中止時
スクリーニング
安全性評価
有効性評価
DLT評価期間
day 1 2
8 15 22※
1
15
1
15
1
8週ごと(24週まで)
・・・
12週ごと(25週以降)
・・・
・・・
・・・
<中間解析の実施>
• コホートごとに6例が登録された時点で中間解析を行う。6例のうちDLT相当の有害事象発現を認めた症例が2例以下かつ8週時点でのSD以上の有
効例が1例以上の場合に当該コホートを継続する。ただし6例のうち5例以上増悪が観察された場合、増悪が4例以下であるもののSD以上の有効
例がない場合は、当該コホートの登録の一時中断ないしは中止の必要性を検討する。
20
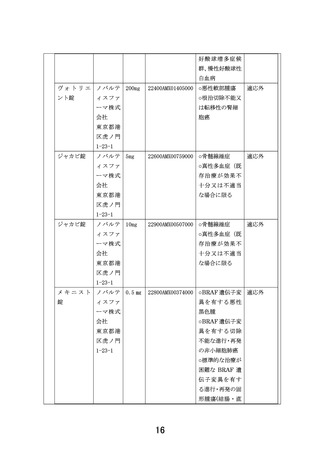
複数の分子標的治療に関する患者申出療養(PARTNER試験)(概要図)
<対象>標準治療がない、または標準治療に不応・不耐で、以下のいずれかを満たす0-29歳の小児・AYAがん患者
①遺伝子パネル検査でエビデンスレベルD以上と判定されたactionableな遺伝子異常を有することが判明している。
②本邦または海外(FDAまたはEMA)において薬事承認された分子標的薬の適応がん種と病理学的に診断されている。
<目的>小児に対して一定の安全性情報があり有効性が期待される適応外薬あるいは未承認薬の安全性および有効性を評価する。必要な場合には
PKデータを収集し薬物動態を評価する。医薬品の適応拡大などに利活用可能な形で情報を収集することも目的とする。
<主要評価項目> 各医薬品コホートにおける用量制限毒性(Dose Limiting Toxicity, DLT)相当の有害事象発現割合
<副次評価項目> 各医薬品コホートにおける有害事象発生割合、奏効割合、病勢制御割合、無増悪生存期間、全生存期間、薬物動態パラメータ
(医薬品ごとに規定)、必要に応じて、がん種別、遺伝子異常別にサブグループ解析を行う。
<症例登録予定> 症例数見込み:医薬品コホート毎に最大30症例 (6症例で中間解析)、登録期間:3年、追跡期間:登録終了後1年
<投与方法と評価スケジュール>
• 各医薬品における研究計画実施計画書補遺に従ってプロトコール治療を行う。1コースは21日または28日とする。
• 安全性評価は、1サイクルは1週毎、2-3サイクルは1日目、15日目に行う。4サイクル以降は各コース1日目で実施する。
• 有効性評価は、治療開始後24週までは8週ごと、25週以降は12週ごとに実施する。
同意取得
登録 治療開始
21日 or 28日
2コース目
3コース目
・・・
Xコース目
各コースday1で実施
・・・
1
4コース目
・・・
中止時
スクリーニング
安全性評価
有効性評価
DLT評価期間
day 1 2
8 15 22※
1
15
1
15
1
8週ごと(24週まで)
・・・
12週ごと(25週以降)
・・・
・・・
・・・
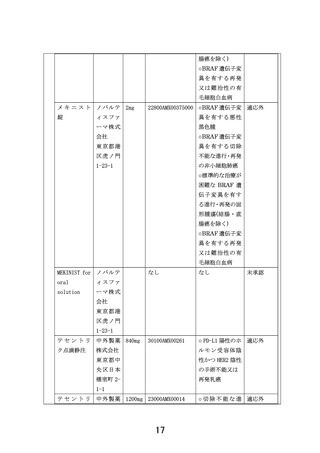
<中間解析の実施>
• コホートごとに6例が登録された時点で中間解析を行う。6例のうちDLT相当の有害事象発現を認めた症例が2例以下かつ8週時点でのSD以上の有
効例が1例以上の場合に当該コホートを継続する。ただし6例のうち5例以上増悪が観察された場合、増悪が4例以下であるもののSD以上の有効
例がない場合は、当該コホートの登録の一時中断ないしは中止の必要性を検討する。
20