よむ、つかう、まなぶ。
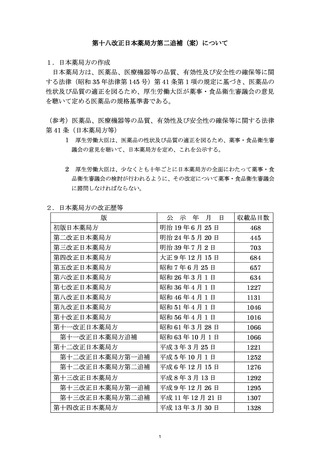
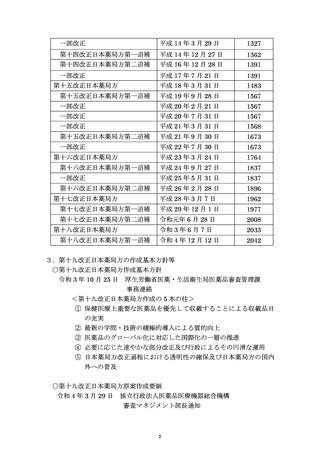
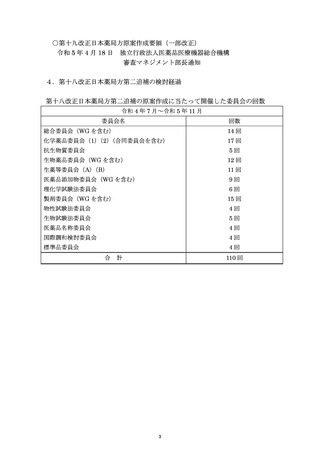
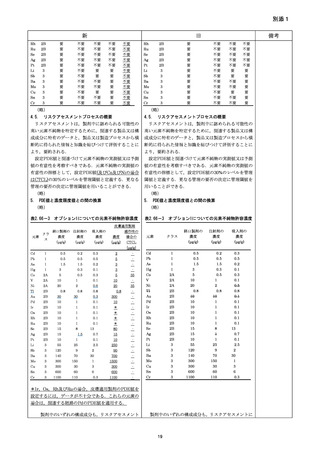
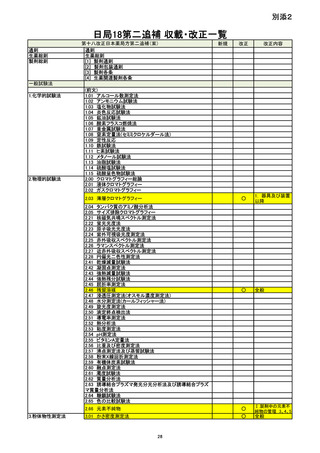
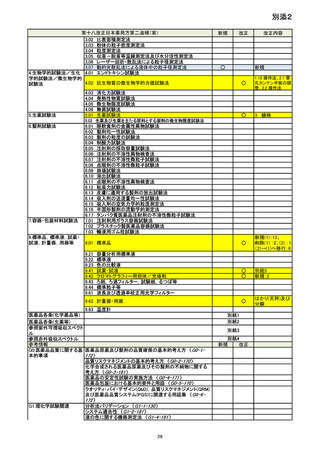
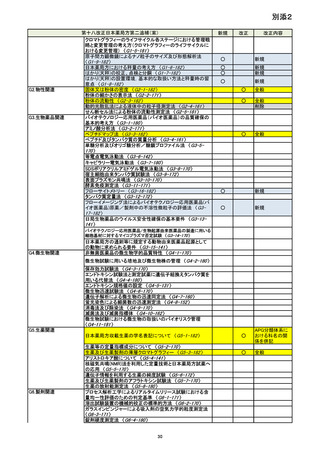
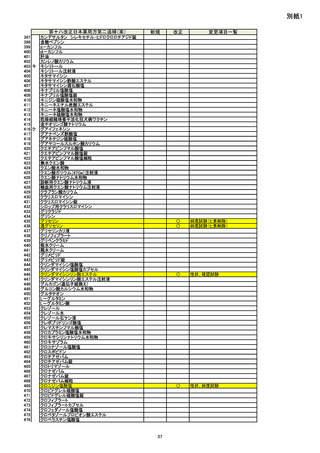
資料No.1_第十八改正日本薬局方第二追補(案)について (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000174942_00008.html |
| 出典情報 | 薬事・食品衛生審議会 日本薬局方部会(令和5年度第1回 1/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別添1
新
旧
溶媒クラス2B標準品,残留溶媒クラス2C標準品,残留溶
留溶媒クラス2B標準品,残留溶媒クラス2C標準品のいず
媒クラス2D標準品,残留溶媒クラス2E標準品のいずれに
れにも含まれていないため,必要に応じて適切なバリデ
も含まれていないため,必要に応じて適切なバリデート
ートされた方法で分析する必要がある.
備考
された方法で分析する必要がある.
(略)
(略)
2. クラス3の溶媒
2. クラス3の溶媒
(略)
(略)
3. 標準品
3. 標準品
(ⅰ) 残留溶媒クラス1標準品(ベンゼン,四塩化炭素,1,2
(ⅰ) 残留溶媒クラス1標準品(ベンゼン,四塩化炭素,1,2
-ジクロロエタン,1,1-ジクロロエテン,1,1,1-トリク
-ジクロロエタン,1,1-ジクロロエテン,1,1,1-トリク
ロロエタンの混合溶液)
ロロエタンの混合溶液)
(ⅱ) 残留溶媒クラス2A標準品(アセトニトリル,クロロ
(ⅱ) 残留溶媒クラス2A標準品(アセトニトリル,クロロ
ベンゼン,クメン,シクロヘキサン,1,2-ジクロロエテ
ベンゼン,クメン,シクロヘキサン,1,2-ジクロロエテ
ン(cis-1,2-ジクロロエテン,trans-1,2-ジクロロエ
ン(cis-1,2-ジクロロエテン,trans-1,2-ジクロロエ
テン),ジクロロメタン,1,4-ジオキサン,メタノール, テン),ジクロロメタン,1,4-ジオキサン,メタノール,
メチルシクロヘキサン,テトラヒドロフラン,トルエン, メチルシクロヘキサン,テトラヒドロフラン,トルエン,
キシレン(エチルベンゼン,m-キシレン,o-キシレン, キシレン(エチルベンゼン,m-キシレン,o-キシレン,
p-キシレン)の混合溶液)
p-キシレン)の混合溶液)
(ⅲ) 残留溶媒クラス2B標準品(クロロホルム,1,2-ジメ
(ⅲ) 残留溶媒クラス2B標準品(クロロホルム,1,2-ジメ
トキシエタン,ヘキサン,メチルブチルケトン,ニトロ
トキシエタン,ヘキサン,メチルブチルケトン,ニトロ
メタン,ピリジン,テトラリン,1,1,2-トリクロロエテ
メタン,ピリジン,テトラリン,1,1,2-トリクロロエテ
ンの混合溶液)
ンの混合溶液)
(ⅳ)
(ⅳ)
残留溶媒クラス2C標準品(メチルイソブチルケト
ン)
残留溶媒クラス2C標準品(メチルイソブチルケト
ン)
(ⅴ) 残留溶媒クラス2D標準品(t-ブチルアルコール)
(ⅵ)
残留溶媒クラス2E標準品(シクロペンチルメチル
エーテル)
(ⅶ) システム適合性試験用残留溶媒標準品(アセトニト
(ⅴ) システム適合性試験用残留溶媒標準品(アセトニト
リル,cis-1,2-ジクロロエテン,ジクロロメタンの混合
リル,cis-1,2-ジクロロエテン,ジクロロメタンの混合
溶液)
溶液)
2.66 元素不純物
新
2.66
元素不純物
旧
2.66 元素不純物
備考
令和 5 年 1 月 20
日付薬生薬審発
Ⅰ.
3.
製剤中の元素不純物の管理
経口製剤,注射剤,吸入剤及び皮膚に適用する製剤
(皮膚適用製剤)における元素不純物のPDEとリスクによ
Ⅰ.
3.
製剤中の元素不純物の管理
経口製剤,注射剤及び吸入剤における元素不純物の
PDEとリスクによる分類
る分類
経口製剤,注射剤,吸入剤及び皮膚適用製剤に対して
経口製剤,注射剤及び吸入剤に対して設定された元素
設定された元素不純物のPDE値を表2.66-1に示す.皮膚
不純物のPDE値を表2.66-1に示す.他の投与経路の
適用製剤のPDE値と皮膚及び経皮濃度限度値(CTCL)を
PDEが必要な場合には,通例,設定の起点として経口曝
有する元素の場合,両方の限度値に適合することが必要
露時のPDE値を考慮し,意図する投与経路により投与し
である.他の投与経路のPDEが必要な場合には,通例,
たときに,元素不純物が局所作用を示すことが予想され
設定の起点として経口曝露時のPDE値を考慮し,意図す
るかどうかを評価する.
る投与経路により投与したときに,元素不純物が局所作
0120 第 1 号「医
薬品元素不純物
ガイドラインの
改正について」
の発出を踏ま
え、皮膚及び経
皮曝露の元素不
純物の限度値を
追加する他、金、
銀及びニッケル
の許容一日曝露
量を修正する。
用を示すことが予想されるかどうかを評価する.
ここで,最大1日投与容量が2 L以下の注射剤は,最大1
ここで,最大1日投与容量が2 L以下の注射剤は,最大1
日投与容量を用いて,PDE値から許容濃度を計算する.
日投与容量を用いて,PDE値から許容濃度を計算する.
1日投与容量,あるいは一般的な臨床使用量が,1日当た
1日投与容量,あるいは一般的な臨床使用量が,1日当た
り2 Lを超える製剤 (生理食塩液,ブドウ糖注射液,完全
り2 Lを超える製剤 (生理食塩水,ブドウ糖液,完全静脈
静脈栄養剤,洗浄用水など)では,PDE値からの許容濃度
栄養剤,洗浄用水など)では,PDE値からの許容濃度の計
17
新
旧
溶媒クラス2B標準品,残留溶媒クラス2C標準品,残留溶
留溶媒クラス2B標準品,残留溶媒クラス2C標準品のいず
媒クラス2D標準品,残留溶媒クラス2E標準品のいずれに
れにも含まれていないため,必要に応じて適切なバリデ
も含まれていないため,必要に応じて適切なバリデート
ートされた方法で分析する必要がある.
備考
された方法で分析する必要がある.
(略)
(略)
2. クラス3の溶媒
2. クラス3の溶媒
(略)
(略)
3. 標準品
3. 標準品
(ⅰ) 残留溶媒クラス1標準品(ベンゼン,四塩化炭素,1,2
(ⅰ) 残留溶媒クラス1標準品(ベンゼン,四塩化炭素,1,2
-ジクロロエタン,1,1-ジクロロエテン,1,1,1-トリク
-ジクロロエタン,1,1-ジクロロエテン,1,1,1-トリク
ロロエタンの混合溶液)
ロロエタンの混合溶液)
(ⅱ) 残留溶媒クラス2A標準品(アセトニトリル,クロロ
(ⅱ) 残留溶媒クラス2A標準品(アセトニトリル,クロロ
ベンゼン,クメン,シクロヘキサン,1,2-ジクロロエテ
ベンゼン,クメン,シクロヘキサン,1,2-ジクロロエテ
ン(cis-1,2-ジクロロエテン,trans-1,2-ジクロロエ
ン(cis-1,2-ジクロロエテン,trans-1,2-ジクロロエ
テン),ジクロロメタン,1,4-ジオキサン,メタノール, テン),ジクロロメタン,1,4-ジオキサン,メタノール,
メチルシクロヘキサン,テトラヒドロフラン,トルエン, メチルシクロヘキサン,テトラヒドロフラン,トルエン,
キシレン(エチルベンゼン,m-キシレン,o-キシレン, キシレン(エチルベンゼン,m-キシレン,o-キシレン,
p-キシレン)の混合溶液)
p-キシレン)の混合溶液)
(ⅲ) 残留溶媒クラス2B標準品(クロロホルム,1,2-ジメ
(ⅲ) 残留溶媒クラス2B標準品(クロロホルム,1,2-ジメ
トキシエタン,ヘキサン,メチルブチルケトン,ニトロ
トキシエタン,ヘキサン,メチルブチルケトン,ニトロ
メタン,ピリジン,テトラリン,1,1,2-トリクロロエテ
メタン,ピリジン,テトラリン,1,1,2-トリクロロエテ
ンの混合溶液)
ンの混合溶液)
(ⅳ)
(ⅳ)
残留溶媒クラス2C標準品(メチルイソブチルケト
ン)
残留溶媒クラス2C標準品(メチルイソブチルケト
ン)
(ⅴ) 残留溶媒クラス2D標準品(t-ブチルアルコール)
(ⅵ)
残留溶媒クラス2E標準品(シクロペンチルメチル
エーテル)
(ⅶ) システム適合性試験用残留溶媒標準品(アセトニト
(ⅴ) システム適合性試験用残留溶媒標準品(アセトニト
リル,cis-1,2-ジクロロエテン,ジクロロメタンの混合
リル,cis-1,2-ジクロロエテン,ジクロロメタンの混合
溶液)
溶液)
2.66 元素不純物
新
2.66
元素不純物
旧
2.66 元素不純物
備考
令和 5 年 1 月 20
日付薬生薬審発
Ⅰ.
3.
製剤中の元素不純物の管理
経口製剤,注射剤,吸入剤及び皮膚に適用する製剤
(皮膚適用製剤)における元素不純物のPDEとリスクによ
Ⅰ.
3.
製剤中の元素不純物の管理
経口製剤,注射剤及び吸入剤における元素不純物の
PDEとリスクによる分類
る分類
経口製剤,注射剤,吸入剤及び皮膚適用製剤に対して
経口製剤,注射剤及び吸入剤に対して設定された元素
設定された元素不純物のPDE値を表2.66-1に示す.皮膚
不純物のPDE値を表2.66-1に示す.他の投与経路の
適用製剤のPDE値と皮膚及び経皮濃度限度値(CTCL)を
PDEが必要な場合には,通例,設定の起点として経口曝
有する元素の場合,両方の限度値に適合することが必要
露時のPDE値を考慮し,意図する投与経路により投与し
である.他の投与経路のPDEが必要な場合には,通例,
たときに,元素不純物が局所作用を示すことが予想され
設定の起点として経口曝露時のPDE値を考慮し,意図す
るかどうかを評価する.
る投与経路により投与したときに,元素不純物が局所作
0120 第 1 号「医
薬品元素不純物
ガイドラインの
改正について」
の発出を踏ま
え、皮膚及び経
皮曝露の元素不
純物の限度値を
追加する他、金、
銀及びニッケル
の許容一日曝露
量を修正する。
用を示すことが予想されるかどうかを評価する.
ここで,最大1日投与容量が2 L以下の注射剤は,最大1
ここで,最大1日投与容量が2 L以下の注射剤は,最大1
日投与容量を用いて,PDE値から許容濃度を計算する.
日投与容量を用いて,PDE値から許容濃度を計算する.
1日投与容量,あるいは一般的な臨床使用量が,1日当た
1日投与容量,あるいは一般的な臨床使用量が,1日当た
り2 Lを超える製剤 (生理食塩液,ブドウ糖注射液,完全
り2 Lを超える製剤 (生理食塩水,ブドウ糖液,完全静脈
静脈栄養剤,洗浄用水など)では,PDE値からの許容濃度
栄養剤,洗浄用水など)では,PDE値からの許容濃度の計
17