よむ、つかう、まなぶ。
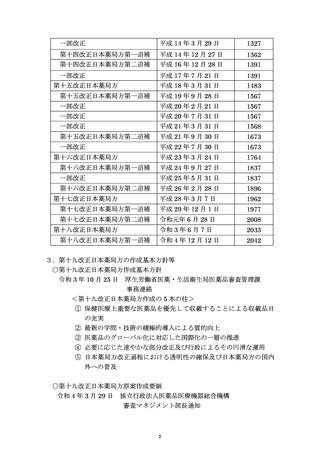
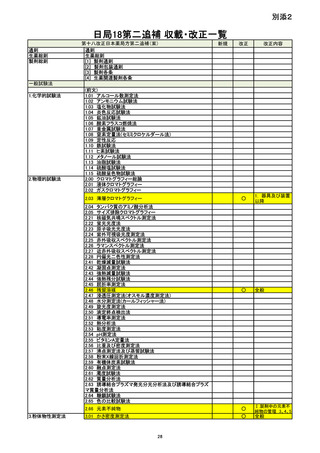
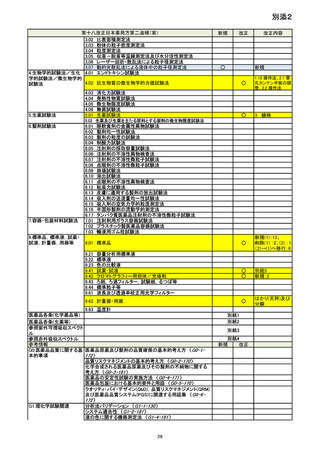
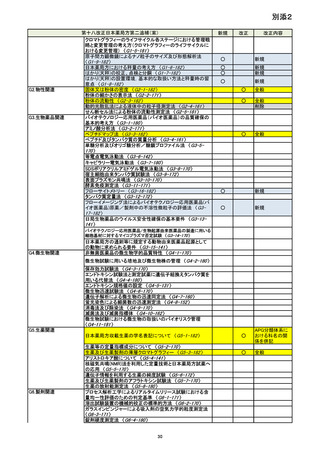
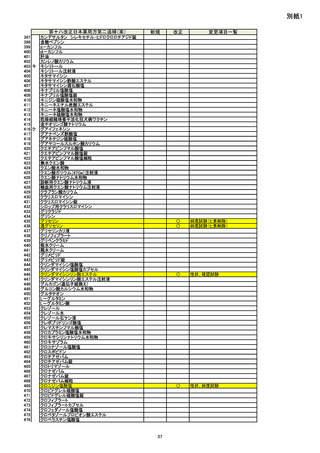
資料No.1_第十八改正日本薬局方第二追補(案)について (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000174942_00008.html |
| 出典情報 | 薬事・食品衛生審議会 日本薬局方部会(令和5年度第1回 1/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
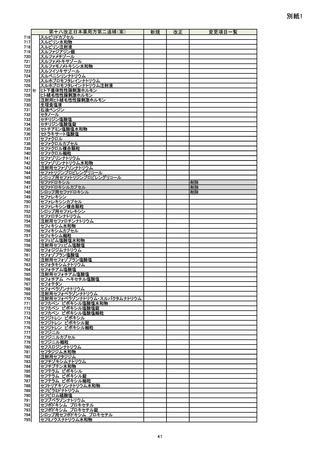
別添1
新
Rh
Ru
Se
Ag
Pt
Li
Sb
Ba
Mo
Cu
Sn
Cr
2B
2B
2B
2B
2B
3
3
3
3
3
3
3
要
要
要
要
要
要
要
要
要
要
要
要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
旧
不要
不要
不要
不要
不要
要
要
不要
不要
要
不要
不要
不要
不要
不要
不要
不要
要
要
要
要
要
要
要
Rh
Ru
Se
Ag
Pt
Li
Sb
Ba
Mo
Cu
Sn
Cr
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
(略)
4.5.
2B
2B
2B
2B
2B
3
3
3
3
3
3
3
要
要
要
要
要
要
要
要
要
要
要
要
備考
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
要
要
不要
不要
要
不要
不要
不要
不要
不要
不要
不要
要
要
要
要
要
要
要
(略)
リスクアセスメントプロセスの概要
4.5.
リスクアセスメントプロセスの概要
リスクアセスメントは,製剤中に認められる可能性の
リスクアセスメントは,製剤中に認められる可能性の
高い元素不純物を特定するために,関連する製品又は構
高い元素不純物を特定するために,関連する製品又は構
成成分に特有のデータと,製品又は製造プロセスから横
成成分に特有のデータと,製品又は製造プロセスから横
断的に得られた情報と知識を結びつけて評価することに
断的に得られた情報と知識を結びつけて評価することに
より,要約される.
より,要約される.
設定PDE値と関連づけて元素不純物の実測値又は予測
設定PDE値と関連づけて元素不純物の実測値又は予測
値の有意性を考察すべきである.元素不純物の実測値の
値の有意性を考察すべきである.元素不純物の実測値の
有意性の指標として,設定PDE値(及びCo及びNiの場合
有意性の指標として,設定PDE値の30%のレベルを管理
はCTCL)の30%のレベルを管理閾値と定義する.更なる
閾値と定義する.更なる管理の要否の決定に管理閾値を
管理の要否の決定に管理閾値を用いることができる.
用いることができる.
(略)
(略)
5. PDE値と濃度限度値との間の換算
5. PDE値と濃度限度値との間の換算
(略)
(略)
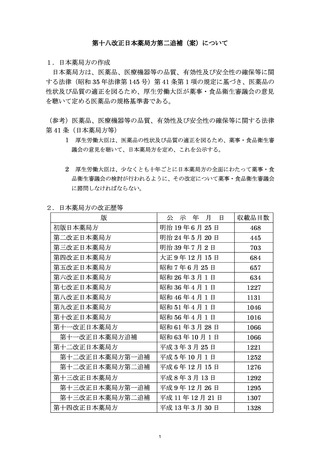
表2.66-3 オプション1についての元素不純物許容濃度
表2.66-3 オプション1についての元素不純物許容濃度
皮膚適用製剤
元素
クラ
ス
経口製剤の 注射剤の
吸入剤の
元素
クラス
経口製剤の
濃度
(μg/g)
注射剤の
濃度
(μg/g)
吸入剤の
濃度
(μg/g)
Cd
Pb
As
Hg
Co
V
Ni
TI
Au
Pd
Ir
Os
Rh
Ru
Se
Ag
Pt
Li
Sb
Ba
Mo
Cu
Sn
Cr
1
1
1
1
2A
2A
2A
2B
2B
2B
2B
2B
2B
2B
2B
2B
2B
3
3
3
3
3
3
3
0.5
0.5
1.5
3
5
10
20
0.8
10
10
10
10
10
10
15
15
10
55
120
140
300
300
600
1100
0.2
0.5
1.5
0.3
0.5
1
2
0.8
10
1
1
1
1
1
8
1
1
25
9
70
150
30
60
110
0.3
0.5
0.2
0.1
0.3
0.1
0.5
0.8
0.1
0.1
0.1
0.1
0.1
0.1
13
0.7
0.1
2.5
2
30
1
3
6
0.3
感作性の
濃度
濃度
濃度
濃度
場合の
(μg/g)
(μg/g)
(μg/g)
(μg/g)
CTCL
(μg/g)
Cd
1
0.5
0.2
0.3
2
‐
Pb
1
0.5
0.5
0.5
5
‐
As
1
1.5
1.5
0.2
3
‐
Hg
1
3
0.3
0.1
3
‐
Co
2A
5
0.5
0.3
5
35
V
2A
10
1
0.1
10
‐
Ni
2A
20
2
0.6
20
35
Tl
2B
0.8
0.8
Au
2B
30
30
0.3
300
‐
Pd
2B
10
1
0.1
10
‐
Ir
2B
10
1
0.1
*
‐
Os
2B
10
1
0.1
*
‐
Rh
2B
10
1
0.1
*
‐
Ru
2B
10
1
0.1
*
‐
Se
2B
15
8
80
‐
Ag
2B
15
1.5
0.7
15
‐
Pt
2B
10
1
0.1
10
‐
Li
3
55
25
2.5
250
‐
Sb
3
120
9
2
90
‐
Ba
3
140
70
30
700
‐
Mo
3
300
150
1
1500
‐
Cu
3
300
30
3
300
‐
Sn
3
600
60
6
600
‐
Cr
3
1100
110
0.3
1100
‐
0.8
13
0.8
‐
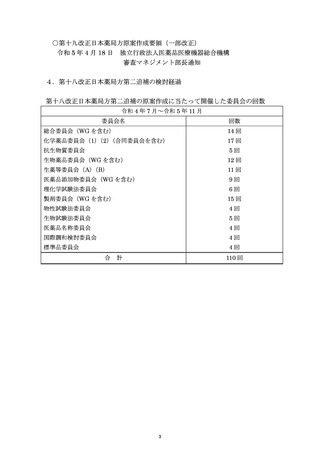
*Ir,Os,Rh及びRuの場合,皮膚適用製剤のPDE値を
設定するには,データが不十分である.これらの元素の
場合は,関連する経路のPdのPDE値を適用する.
製剤中のいずれの構成成分も,リスクアセスメント
製剤中のいずれの構成成分も,リスクアセスメントに
19
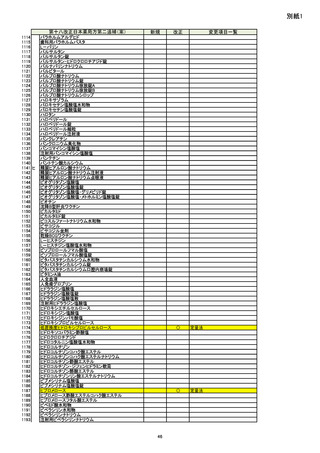
新
Rh
Ru
Se
Ag
Pt
Li
Sb
Ba
Mo
Cu
Sn
Cr
2B
2B
2B
2B
2B
3
3
3
3
3
3
3
要
要
要
要
要
要
要
要
要
要
要
要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
旧
不要
不要
不要
不要
不要
要
要
不要
不要
要
不要
不要
不要
不要
不要
不要
不要
要
要
要
要
要
要
要
Rh
Ru
Se
Ag
Pt
Li
Sb
Ba
Mo
Cu
Sn
Cr
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
(略)
4.5.
2B
2B
2B
2B
2B
3
3
3
3
3
3
3
要
要
要
要
要
要
要
要
要
要
要
要
備考
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
要
要
不要
不要
要
不要
不要
不要
不要
不要
不要
不要
要
要
要
要
要
要
要
(略)
リスクアセスメントプロセスの概要
4.5.
リスクアセスメントプロセスの概要
リスクアセスメントは,製剤中に認められる可能性の
リスクアセスメントは,製剤中に認められる可能性の
高い元素不純物を特定するために,関連する製品又は構
高い元素不純物を特定するために,関連する製品又は構
成成分に特有のデータと,製品又は製造プロセスから横
成成分に特有のデータと,製品又は製造プロセスから横
断的に得られた情報と知識を結びつけて評価することに
断的に得られた情報と知識を結びつけて評価することに
より,要約される.
より,要約される.
設定PDE値と関連づけて元素不純物の実測値又は予測
設定PDE値と関連づけて元素不純物の実測値又は予測
値の有意性を考察すべきである.元素不純物の実測値の
値の有意性を考察すべきである.元素不純物の実測値の
有意性の指標として,設定PDE値(及びCo及びNiの場合
有意性の指標として,設定PDE値の30%のレベルを管理
はCTCL)の30%のレベルを管理閾値と定義する.更なる
閾値と定義する.更なる管理の要否の決定に管理閾値を
管理の要否の決定に管理閾値を用いることができる.
用いることができる.
(略)
(略)
5. PDE値と濃度限度値との間の換算
5. PDE値と濃度限度値との間の換算
(略)
(略)
表2.66-3 オプション1についての元素不純物許容濃度
表2.66-3 オプション1についての元素不純物許容濃度
皮膚適用製剤
元素
クラ
ス
経口製剤の 注射剤の
吸入剤の
元素
クラス
経口製剤の
濃度
(μg/g)
注射剤の
濃度
(μg/g)
吸入剤の
濃度
(μg/g)
Cd
Pb
As
Hg
Co
V
Ni
TI
Au
Pd
Ir
Os
Rh
Ru
Se
Ag
Pt
Li
Sb
Ba
Mo
Cu
Sn
Cr
1
1
1
1
2A
2A
2A
2B
2B
2B
2B
2B
2B
2B
2B
2B
2B
3
3
3
3
3
3
3
0.5
0.5
1.5
3
5
10
20
0.8
10
10
10
10
10
10
15
15
10
55
120
140
300
300
600
1100
0.2
0.5
1.5
0.3
0.5
1
2
0.8
10
1
1
1
1
1
8
1
1
25
9
70
150
30
60
110
0.3
0.5
0.2
0.1
0.3
0.1
0.5
0.8
0.1
0.1
0.1
0.1
0.1
0.1
13
0.7
0.1
2.5
2
30
1
3
6
0.3
感作性の
濃度
濃度
濃度
濃度
場合の
(μg/g)
(μg/g)
(μg/g)
(μg/g)
CTCL
(μg/g)
Cd
1
0.5
0.2
0.3
2
‐
Pb
1
0.5
0.5
0.5
5
‐
As
1
1.5
1.5
0.2
3
‐
Hg
1
3
0.3
0.1
3
‐
Co
2A
5
0.5
0.3
5
35
V
2A
10
1
0.1
10
‐
Ni
2A
20
2
0.6
20
35
Tl
2B
0.8
0.8
Au
2B
30
30
0.3
300
‐
Pd
2B
10
1
0.1
10
‐
Ir
2B
10
1
0.1
*
‐
Os
2B
10
1
0.1
*
‐
Rh
2B
10
1
0.1
*
‐
Ru
2B
10
1
0.1
*
‐
Se
2B
15
8
80
‐
Ag
2B
15
1.5
0.7
15
‐
Pt
2B
10
1
0.1
10
‐
Li
3
55
25
2.5
250
‐
Sb
3
120
9
2
90
‐
Ba
3
140
70
30
700
‐
Mo
3
300
150
1
1500
‐
Cu
3
300
30
3
300
‐
Sn
3
600
60
6
600
‐
Cr
3
1100
110
0.3
1100
‐
0.8
13
0.8
‐
*Ir,Os,Rh及びRuの場合,皮膚適用製剤のPDE値を
設定するには,データが不十分である.これらの元素の
場合は,関連する経路のPdのPDE値を適用する.
製剤中のいずれの構成成分も,リスクアセスメント
製剤中のいずれの構成成分も,リスクアセスメントに
19