よむ、つかう、まなぶ。
資料3-2 医療機器基本計画に関するKPIのフォローアップについて (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38515.html |
| 出典情報 | 国民が受ける医療の質の向上のための医療機器の研究開発及び普及の促進に関する検討会(第4回 3/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
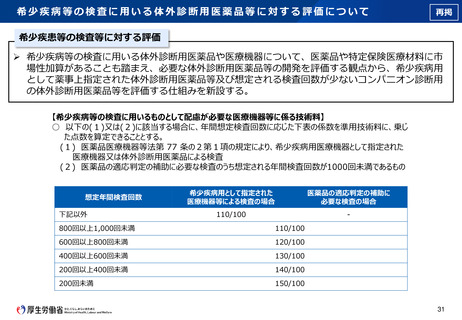
倫理審査委員会における審査の均てん化について
再掲
倫理指針ガイダンスにおいて、一括審査をする際の考え方を示し、周知している。
第6 研究計画書に関する手続
2 倫理審査委員会への付議
⑴ 研究責任者は、研究の実施の適否について、倫理審査委員会の意見を聴かなければならない。
⑵ 研究代表者は、原則として、多機関共同研究に係る研究計画書について、一の倫理審査委員会による一括した審査を求めなければならない。
⑶ 研究責任者は、倫理審査委員会に意見を聴いた後に、その結果及び当該倫理審査委員会に提出した書類、その他研究機関の長が求める書類を
研究機関の長に提出し、当該研究機関における当該研究の実施について、許可を受けなければならない。
⑷(略)
⑸ 研究責任者は、多機関共同研究について⑵の規定によらず個別の倫理審査委員会の意見を聴く場合には、共同研究機関における研究の実施の
許可、他の倫理審査委員会における審査結果及び当該研究の進捗に関する状況等の審査に必要な情報についても当該倫理審査委員会へ提供しな
ければならない。
○
⑵の規定では、研究代表者が一の倫理審査委員会に審査を求める場合、関係する研究機関と事前に調整を行った上で、審査の依頼を行う等の
手続が必要となる。なお、この場合は第17の4(1)に従い、研究機関における研究の実施体制についても審査するため、併せて当該体制に係る情
報を提供すること。また、既に開始されている研究に後から共同研究機関として参画する場合は、別途、同じ倫理審査委員会の意見を聴く必要
がある。
また、各研究機関の状況等を踏まえ、共同研究機関と一括した倫理審査委員会の審査を受けず、個別の倫理審査委員会の意見を聴くことを妨
げるものではない。
○
⑶の規定において、一括した審査を行った場合、研究代表者は当該審査結果、審査過程のわかる記録及び当該倫理審査委員会の委員の出欠状
況を共同研究機関の研究責任者に共有し、各研究機関の研究責任者はそれをもって当該研究機関の長に研究の実施の許可を受ける必要がある。
○
⑵及び⑸の規定において、研究責任(代表)者は、各研究機関の体制、研究内容等を踏まえ、研究責任(代表)者間において、十分に協議し
審査方法を決める必要がある。
○
多機関共同研究として倫理審査委員会に審査を求める場合、「一の倫理審査委員会による場合」、「個別の倫理審査委員会による場合」が混
在することを妨げるものではない。
11
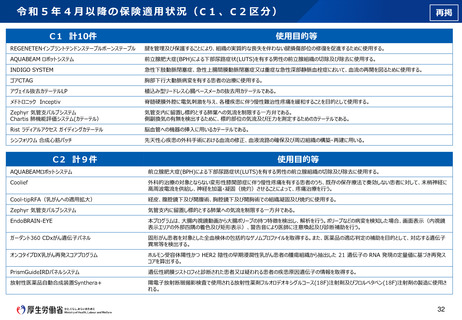
再掲
倫理指針ガイダンスにおいて、一括審査をする際の考え方を示し、周知している。
第6 研究計画書に関する手続
2 倫理審査委員会への付議
⑴ 研究責任者は、研究の実施の適否について、倫理審査委員会の意見を聴かなければならない。
⑵ 研究代表者は、原則として、多機関共同研究に係る研究計画書について、一の倫理審査委員会による一括した審査を求めなければならない。
⑶ 研究責任者は、倫理審査委員会に意見を聴いた後に、その結果及び当該倫理審査委員会に提出した書類、その他研究機関の長が求める書類を
研究機関の長に提出し、当該研究機関における当該研究の実施について、許可を受けなければならない。
⑷(略)
⑸ 研究責任者は、多機関共同研究について⑵の規定によらず個別の倫理審査委員会の意見を聴く場合には、共同研究機関における研究の実施の
許可、他の倫理審査委員会における審査結果及び当該研究の進捗に関する状況等の審査に必要な情報についても当該倫理審査委員会へ提供しな
ければならない。
○
⑵の規定では、研究代表者が一の倫理審査委員会に審査を求める場合、関係する研究機関と事前に調整を行った上で、審査の依頼を行う等の
手続が必要となる。なお、この場合は第17の4(1)に従い、研究機関における研究の実施体制についても審査するため、併せて当該体制に係る情
報を提供すること。また、既に開始されている研究に後から共同研究機関として参画する場合は、別途、同じ倫理審査委員会の意見を聴く必要
がある。
また、各研究機関の状況等を踏まえ、共同研究機関と一括した倫理審査委員会の審査を受けず、個別の倫理審査委員会の意見を聴くことを妨
げるものではない。
○
⑶の規定において、一括した審査を行った場合、研究代表者は当該審査結果、審査過程のわかる記録及び当該倫理審査委員会の委員の出欠状
況を共同研究機関の研究責任者に共有し、各研究機関の研究責任者はそれをもって当該研究機関の長に研究の実施の許可を受ける必要がある。
○
⑵及び⑸の規定において、研究責任(代表)者は、各研究機関の体制、研究内容等を踏まえ、研究責任(代表)者間において、十分に協議し
審査方法を決める必要がある。
○
多機関共同研究として倫理審査委員会に審査を求める場合、「一の倫理審査委員会による場合」、「個別の倫理審査委員会による場合」が混
在することを妨げるものではない。
11